
【题目】标准状况下,下列实验用如图所示装置不能完成的是

A.测定一定质量的Cu和Mg混合物中Cu的含量
B.确定分子式为C2H6O的有机物分子中含活泼氢原子的个数
C.比较Fe3+和Cu2+对一定质量的双氧水分解反应的催化效率
D.测定一定质量的Na2SO4·xH2O晶体中结晶水数目
【答案】D
【解析】
A. 在烧瓶中放入一定质量的Cu和Mg混合物,然后将盐酸从分液漏斗滴下,Mg与盐酸反应产生氢气,而Cu不能发生反应,根据氢气体积计算镁的质量,进而可计算得到混合物中Cu的含量,A正确;
B. 在烧瓶中放入足量金属Na,然后将一定量的有机物从分液漏斗逐滴滴下,若产生气体则有机物为乙醇,结构简式为CH3CH2OH,根据产生氢气体积计算出分子式为C2H6O的有机物分子中含活泼氢原子的个数,若不产生气体,则物质结构简式为CH3-O-CH3,B正确;
D. 可通过对照实验比较单位时间内Fe3+和Cu2+与双氧水反应产生气体多少比较催化效率,C正确;
C. 该实验装置需要测量生成气体的量进而计算,而测定Na2SO4·xH2O晶体中结晶水时不能产生气体,因此使用该装置不能完成实验,D错误;
故合理选项是D。


科目:高中化学 来源: 题型:
【题目】2018年6月27日,国务院发布《打赢蓝天保卫战三年行动计划》,该计划是中国政府部署的一项污染防治行动计划,旨在持续改善空气质量,为群众留住更多蓝天。对废气的进行必要的处理,让空气更加清洁是环境科学的重要课题。
(1)已知:N2(g)+O2(g)=2NO(g) △H1=+180.5kJ/mol
C (s)+O2(g)=CO2(g) △H2=-393.5kJ/mol
2C (s)+O2(g)=2CO(g) △H3=-221.0kJ/mol
若某反应的平衡常数表达式为![]() ,请写出此反应的热化学方程式_________________。
,请写出此反应的热化学方程式_________________。
(2)用如图所示的电解装置可将雾霾中的NO、SO2分别转化为NH![]() 和SO
和SO![]()
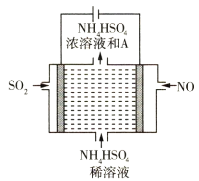
①写出物质A的化学式____________。
②NO在电极上发生的反应为 _________________。
SO2在电极上发生的反应为 __________________。
(3)工业上常用氨水吸收SO2,可生成NH4HSO3和(NH4)2SO3。
①某同学测得氨水吸收SO2所得溶液中NH4HSO3和(NH4)2SO3的物质的量之比恰好为2:1,写出该吸收过程的总反应方程式______________________________________。
②已知常温下H2S的电离常数Ka1=1.3×10-7,Ka2=7.1×10-15,将等物质的量浓度的NaHS与Na2S溶液等体积混合,所得溶液中离子浓度大小顺序为__________________。(用物质的量浓度符号由大到小排列)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下有关氨气的叙述中不正确的是( )
A.潮湿的氨气可以用浓硫酸干燥
B.氨的喷泉实验体现了氨的溶解性
C.氨具有还原性,一定条件下可与氧气发生反应
D.实验室里可用氨水与生石灰制取少量氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于实验操作的叙述中正确的是( )
①从试剂瓶中取出的任何药品,若有剩余不能再放回原试剂瓶 ②可燃性气体点燃之前必须验纯
③用胶头滴管向试管中滴加液体,一定要将胶头滴管伸入试管中
④用托盘天平称量固体药品时,应左物右码
⑤配制浓硫酸与蒸馏水的混合液时,应将浓硫酸慢慢加到蒸馏水中并及时揽拌和冷却
⑥选用![]() 量筒量取
量筒量取![]() 稀硫酸
稀硫酸
A.①③④⑤B.①③④⑥
C.②④⑤D.以上答案均不正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将agFe2O3、Al2O3的混合固体溶解在200mL0.1mol/L的过量硫酸溶液中,然后向其中加入NaOH溶液使Fe3+、Al3+刚好完全沉淀,用去NaOH溶液100mL,则NaOH溶液的浓度为()
A.0.1mol/LB.0.2mol/LC.0.4mol/LD.0.8mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铟(In)主要应用于透明导电图层、荧光材料、有机合成等,以ITO靶材废料(主要由In2O3、SnO2组成)为原料回收铟的工艺流程如图:
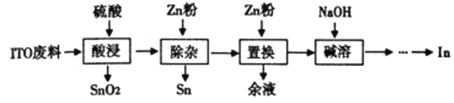
已知:i. 锡、锌的性质均与铝的性质相似.
ii. 铟不与强碱反应,氢氧化铟难与强碱性溶液反应,在较浓的氢氧化钠溶液中也只有少量溶解。
iii. Ksp[In(OH)3]=1×10-33 Ksp[Sn(OH)4]=1×10-56
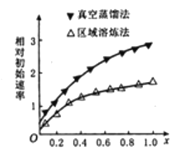
(1)海绵状ITO[xIn2O3(1-x)SnO2]可作异佛尔酮二胺合成的催化剂,如图表示相同条件下,两种不同方法制得的催化剂催化异佛尔酮二胺的相对初始速率随x的变化曲线。真空蒸馏法的相对初始速率较大的原因可能是_________,In2O3、SnO2两种氧化物中,催化效果更好的是__________;
(2)酸浸时,铟的浸出率随温度和硫酸浓度的关系如表,锡的浸出率小于20%。
30℃ | 50℃ | 70℃ | 90℃ | |
3 mol/L H2SO4 | 56% | 72% | 83% | 91% |
4 mol/L H2SO4 | 68% | 81% | 89% | 94% |
①写出“浸出”反应的化学方程式:___________________________;
②由上表信息可得出规律:其他条件不变时,铟的浸出率随温度升高而_____________(填“增大”“减小”或“不变”下同),温度越高,硫酸浓度对铟的浸出率影响__________;
(3)现有一份In2(SO4)3和Sn2(SO4)2的混合溶液,向其中逐渐加入锌粉,测得析出固体的质量随加入锌粉的物质的量关系如图所示:
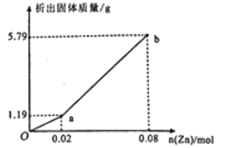
该混合溶液中,In3+和Sn4+的物质的量浓度之比为_______________;
(4)若“浸酸”后的溶液中In2(SO4)3的浓度为1 mol/L,取100 mL该溶液向其中滴加氨水,当Sn4+沉淀完全[设c(Sn4+)=1×10-6 mol/L]时,溶液的pH=____________,此时In3+是否开始形成沉淀_____(填“是”或“否”);
(5)“碱熔”时主要反应的离子方程式为___________;
(6)以粗铟为阳极,纯铟为阴极,H2SO4、NaCl和InCl3混合液为电解液可提纯粗铟。写出阴极反应的电极方程式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是一种重要的化工产品,目前硫酸的主要生产方法是“接触法”,其主要反应之一为2SO2+O2![]() 2SO3。下列有关该反应的说法不正确的是( )
2SO3。下列有关该反应的说法不正确的是( )
A.SO2和O2不可能全部转化为SO3
B.达到平衡后,反应就停止了,故正、逆反应速率相等且均为零
C.该反应从开始到达到平衡的过程中,正反应速率不断减小,逆反应速率不断增大,某一时刻,正、逆反应速率相等
D.工业上生产SO3时,要同时考虑反应所能达到的限度和化学反应速率两方面的问题
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1mol/LKOH溶液滴定10mL0.1mol/LHA溶液的滴定曲线如图所示。下列说法不正确的是( )
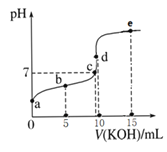
A.a点pH约为3,可以判断HA是弱酸
B.b点溶液:c(A-)>c(K+)>c(HA)>c(H+)>c(OH-)
C.c点溶液:c(K+)=c(A-)
D.水的电离程度:c点>d点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)是一些工厂和矿山废水中的污染元素,使用吸附剂是去除水中砷的有效措施之一。
(1)将硫酸锰、硝酸钇与氢氧化钠溶液按一定比例混合,搅拌使其充分反应,可获得一种砷的高效吸附剂X,吸附剂X中含有![]() ,其原因是_______________________________。
,其原因是_______________________________。
(2)H3AsO3和H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如题20图- 1和题20图- 2所示。

①以酚酞为指示剂(变色范围pH 8.0 ~ 10.0),将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为__________________。
②H3AsO4第一步电离方程式H3AsO4![]() H2AsO4-+H+的电离常数为Ka1,则pKa1=______(p Ka1 = -lg Ka1 )。
H2AsO4-+H+的电离常数为Ka1,则pKa1=______(p Ka1 = -lg Ka1 )。
(3)溶液的pH对吸附剂X表面所带电荷有影响。pH =7.1时, 吸附剂X表面不带电荷; pH > 7.1时带负电荷,pH越高,表面所带负电荷越多;pH<7.1时带正电荷,pH越低,表面所带正电荷越多。pH不同时吸附剂X对三价砷和五价砷的平衡吸附量(吸附达平衡时单位质量吸附剂X吸附砷的质量)如题20图-3所示。

①在pH7~9之间,吸附剂X对五价砷的平衡吸附量随pH升高而迅速下降,其原因是______________。
②在pH4~7之间,吸附剂X对水中三价砷的去除能力远比五价砷的弱,这是因为___________。 提高吸附剂X对三价砷去除效果可采取的措施是_________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com