
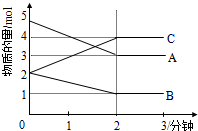
 (1)某可逆反应(ABC均为气体)从0-2分钟进行过程中,在不同反应时间各物质的量的变化情况如图所示.
(1)某可逆反应(ABC均为气体)从0-2分钟进行过程中,在不同反应时间各物质的量的变化情况如图所示.分析 (1)从物质的物质的量的变化趋势判断反应物和生成物,根据物质的物质的量变化值等于化学计量数之比书写化学方程,化学反应速率是单位时间内浓度的变化,当反应达到平衡状态时,各物质的物质的量不再变化.
(2)根据物质浓度概念计算,计算2min末SO3的物质的量结合c=$\frac{n}{V}$进行计算;
(2)依据化学反应速率概念计算,依据题干条件计算二氧化硫的浓度变化,利用v=$\frac{△c}{△t}$进行计算.
解答 解:(1)由图象可以看出,A、B的物质的量逐渐减小,则A、B为反应物,C的物质的量逐渐增多,作为C为生成物,
当反应到达2min时,△n(A)=2mol,△n(B)=1mol,△n(C)=2mol,
化学反应中,各物质的物质的量的变化值与化学计量数呈正比,则△n(A):△n(B):△n(C)=2:1:2,
所以反应的化学方程式为:2A+B?2C,由于不能确定溶液的体积,则不能计算浓度的变化,无法计算反应速率,
故答案为:2A+B?2C,不能,不能计算,因为缺少体积;
(2)2min末:n(SO3)=△n(SO2)=4mol-1.6mol=2.4mol,
c=$\frac{n}{V}$=$\frac{2.4mol}{2L}$=1.2mol/L,
v=$\frac{△c}{△t}$=$\frac{1.2mol/L}{2min}$=0.6mol•L-1•min-1,
故答案为:1.2mol/L,0.6mol•L-1•min-1.
点评 本题考查化学平衡图象问题,题目难度不大,注意把握由图象判断化学方程式的方法,化学反应速率概念和物质浓度概念的计算应用,掌握基础是解题关键.


 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠的摩尔质量为40g | |
| B. | 1摩尔氧原子的质量就是氧的相对原子质量 | |
| C. | H2SO4的摩尔质量为96g•mol-1 | |
| D. | 1molCO2的质量以克为单位时,在数值上等于CO2的相对分子质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 粗铜作阴极? | |
| B. | 用CuSO4作电解质溶液 | |
| C. | 阳极只发生Cu-2e-═Cu2+反应,其它杂质沉淀为阳极泥 | |
| D. | 电解质溶液的组成和浓度都不改变? |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温同压下,相同体积的物质,其物质的量一定相等 | |
| B. | 一氧化碳气体和氮气,若体积相等,则质量一定相等 | |
| C. | 1L一氧化碳气体一定比1L氧气的质量小 | |
| D. | 任何条件下,等物质的量的甲烷和一氧化碳所含的分子数一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
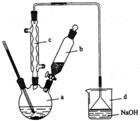 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com