
| A. | 醋酸与碳酸钠反应 CO32-+2H+=CO2↑+H2O | |
| B. | 铁屑与稀硫酸反应 2Fe+6H+═2Fe3++3H2↑ | |
| C. | Na2CO3溶液与澄清石灰水反应 CO32-+Ca2+═CaCO3↓ | |
| D. | H2SO4溶液与Ba(OH)2溶液混合产生沉淀 SO42-+Ba2+═BaSO4↓ |
分析 A.醋酸为弱酸,离子方程式中醋酸不能拆开;
B.铁与稀硫酸反应生成的是亚铁离子;
C.碳酸钠与氢氧化钙反应生成碳酸钙沉淀和氢氧化钠;
D.漏掉了氢离子与氢氧根离子生成水的反应.
解答 解:A.醋酸和碳酸钠反应生成醋酸钠、二氧化碳气体和水,醋酸不能拆开,正确的离子方程式为:CO32-+2CH3COOH=H2O+CO2↑+2CH3COO-,故A错误;
B.铁屑与稀硫酸反应生成硫酸亚铁和氢气,正确的离子方程式为:Fe+2H+═Fe2++H2↑,故B错误;
C.Na2CO3溶液与澄清石灰水反应生成碳酸钙沉淀和氢氧化钠,反应的离子方程式为:CO32-+Ca2+═CaCO3↓,故C正确;
D.H2SO4溶液与Ba(OH)2溶液混合生成硫酸钡沉淀和水,正确的离子方程式为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,故D错误;
故选C.
点评 本题考查了离子方程式的书写判断,为高考的高频题,题目难度不大,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等;试题有利于提高学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 1.0 mol•L-1的KNO3溶液:H+、Fe2+、Cl-、SO42-能共存 | |
| B. | 甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl-能共存 | |
| C. | 0.01mol/LNH4Al(SO4)2溶液与0.01mol/LBa(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3•H2O | |
| D. | 二氧化硫通入次氯酸钠碱性溶液:SO2+ClO-+2OH-=SO42-+Cl-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最外层一定为8个电子 | |
| B. | 第n层上最多容纳2n2个电子 | |
| C. | M层上的电子一定多于L层上的电子 | |
| D. | 稀有气体元素原子最外层电子数一定是所有元素中最多的 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH3+Br2→CH3CH2Br+HBr | |
| B. | 2CH3CHO+O2 $→_{△}^{催化剂}$ 2CH3COOH | |
| C. | CH3CH=CH2+Br2→CH3CHBr-CH2Br | |
| D. | 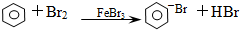 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 2:1 | C. | 1:2 | D. | 4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,当N2的生成速率与N2的分解速率相等时,该反应处于平衡状态 | |
| B. | 取1mol N2和3mol H2放在密闭容器内反应达平衡时,生成2 mol NH3 | |
| C. | 一定条件下反应达到平衡,再充入N2,则正反应速率增大,逆反应速率减小 | |
| D. | 一定条件下反应达到平衡,若升高温度,反应速率增大,平衡向正反应方向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com