
制印刷电路时常用氯化铁溶液作为“腐蚀液”,发生的反应为2FeCl3+Cu=2FeCl2+CuCl2。向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是烧杯中( )
A. 有铜无铁 B. 有铁无铜 C. 铁、铜都有 D. 铁、铜都无
科目:高中化学 来源:2016-2017学年江西省南昌市高二上学期期末考试化学试卷(解析版) 题型:选择题
已知:
2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ·mol-1
Na2O2(s)+CO2(g)=Na2CO3(s)+1/2O2(g) ΔH=-266 kJ·mol-1
根据以上热化学方程式判断,下列说法正确的是( )

A. CO的标准燃烧热为283 kJ
B. 下图可表示由CO生成CO2的反应过程和能量关系
C. 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-532 kJ·mol-1
D. CO(g)与Na2O2(s)反应放出549 kJ热量时,电子转移数为6.02×1023
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省高一下学期开学考试化学试卷(解析版) 题型:选择题
下列关于胶体和溶液的说法中,正确的是
A. 分散系的分类: 分散系微粒直径
分散系微粒直径
B. 溶液是电中性的,而胶体是带电的
C. 光线通过时,溶液产生丁达尔效应,胶体则无丁达尔效应
D. 溶液中溶质粒子能通过滤纸,胶体中分散质粒子不能通过滤纸
查看答案和解析>>
科目:高中化学 来源:2016-2017学年新疆兵团农二师华山中学高一下学期学前考试化学试卷(解析版) 题型:选择题
用98%(质量分数)的浓硫酸来配制一定体积的1.0mol·L-1的稀硫酸时,下列仪器不需要用到的是
A. 玻璃棒 B. 胶头滴管 C. 托盘天平 D. 容量瓶
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省广州市高一上学期期期末考试化学试卷(解析版) 题型:实验题
FeCl3在现代工业生产中应用广泛。某化学研究性学习小组模拟工业流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S。
【查阅资料】1、无水FeCl3在空气中易潮解,加热易升华。
2、氯气(Cl2)是一种有毒的黄绿色气体,能与NaOH溶液反应。
【实验探究】学习小组设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
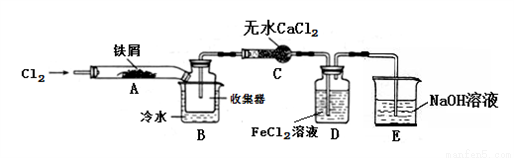
①检验装置的气密性;
②通入干燥的Cl2,赶尽装置中的空气;
③用酒精灯在铁屑下方加热至反应完成;
④……
⑤体系冷却后,停止通入Cl2,并用干燥的N2赶尽Cl2,将收集器密封。
请回答下列问题:
(1)装置A中反应的化学方程式为:______________。
(2)第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A右端。要使沉积的FeCl3进入收集器,第④步操作是:____________。
(3)操作步骤中,为防止FeCl3潮解所采取的措施有(填操作步骤序号)____________。
(4)装置D中FeCl2溶液全部反应后,因失去吸收Cl2的作用而失效,写出证明FeCl2溶液已经失效的操作方法:________________。
(5)该组同学用装置D中的副产品FeCl3溶液吸收H2S,得到黄色固体。请写出该反应的离子方程式:__________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省广州市高一上学期期期末考试化学试卷(解析版) 题型:选择题
同温同压下,等物质的量的SO2和CO2相比较,下列叙述正确的是
① 体积比为 1︰1 ② 密度比为 16︰11
③ 氧原子数比为 1︰1 ④ 质量比为 16︰11
A. ①③④ B. ①②④ C. ②③④ D. 全部
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省广州市高一上学期期期末考试化学试卷(解析版) 题型:选择题
化学与生产、生活密切相关。下列物质用途不正确的是
A. Na2O2 是强氧化剂,有漂白性,可用作食品的漂白剂
B. Al2O3熔点很高,可用作耐火材料,制作耐火管和耐火坩埚
C. NaHCO3能与酸反应,可制成胃药治疗胃酸过多
D. Fe2O3是红棕色固体,可用作红色油漆和涂料
查看答案和解析>>
科目:高中化学 来源:2017届四川省高三2月月考理科综合化学试卷(解析版) 题型:实验题
天津港“8.12”爆炸事故中,因爆炸冲击导致氰化钠泄漏,可以通过喷洒双氧水或硫代硫酸钠溶液来处理,以减轻环境污染.
资料:氰化钠化学式NaCN(C元素+2价,N元素﹣3价),白色结晶颗粒,剧毒,易溶于水,水溶液呈碱性,易水解生成氰化氢.
I、(1)NaCN水溶液呈碱性,其原因是____________(用离子方程式解释).
(2)双氧水氧化法除NaCN:碱性条件下加入H2O2,可得到纯碱和一种无色无味的无毒气体,该反应的离子方程式为____________________.
(3)非金属性N______C(填“<”、“>”或“=”),请设计实验证明:_____________。
II、某化学兴趣小组实验室制备硫代硫酸钠(Na2S2O3),并检测用硫代硫酸钠溶液处理后的氰化钠废水能否达标排放.
[实验一]实验室通过如图装置制备Na2S2O3.

(3)b装置的作用是_______________.
(4)c装置中的产物有Na2S2O3和CO2等,d装置中的溶质有NaOH、Na2CO3,还可能有__.
(5)实验结束后,在e处最好连接盛__(选填“NaOH溶液”、“水”、“CCl4”中任一种)的注射器,再关闭K2打开K1防止拆除装置时污染空气.
[实验二]测定用硫代硫酸钠溶液处理后的废水中氰化钠的含量.
己知:①废水中氰化钠的最高排放标准为0.50mg/L.
②Ag++2CN—=[Ag(CN)2] —,Ag++I—=AgI↓,AgI呈黄色,且CN —优先与Ag+反应.
实验如下.取25.00mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.000×10﹣4mol/L的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为2.50mL.
(6)滴定终点的判断方法是_______________.
(7)处理后的废水中氰化钠的含量为_______________mg/L.
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省长沙市高二下学期第一次模块检测化学试卷(解析版) 题型:选择题
NA为阿伏加德罗常数,下列说法正确的是( )
A. 标准状况下,11.2L的戊烷所含的分子数大于0.5NA
B. 28g乙烯所含共用电子对数目为4NA
C. 标准状况下,11.2 L二氯甲烷所含分子数为0.5NA
D. 现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com