
分析 (1)实验时应先称量一定质量的固体,溶解后配制成溶液,量取待测液与锥形瓶中,然后用标准液进行滴定;
(2)滴定管垂直,液面不再变化时才可读数,视线与溶液凹液面最低点相平,注意滴定管的精确值;
(3)滴定管0刻度在上,滴定前应调节到零刻度或零稍下的某一刻度,为减小误差,尖嘴部分应充满液体,无气泡;
(4)指示剂为甲基橙,变色范围为3.1-4.4;
(5)因标准液浓度变小,用量变大;
(6)根据反应消耗的硫酸,求出氢氧化钠,进一步求出样品的纯度.
解答 解:(1)实验时应先称量一定质量的固体,溶解后配制成溶液,量取待测液与锥形瓶中,然后用标准液进行滴定,
故答案为:A;E;
(2)滴定管垂直,液面不再变化时才可读数,视线与溶液凹液面最低点相平,滴定管读数准确到0.01ml,
故答案为:垂直;凹液面最低点;
(3)滴定管0刻度在上,滴定前应调节到零刻度或零稍下的某一刻度,故答案为:零刻度或零稍下的某一刻度;
(4)指示剂为甲基橙,变色范围为3.1-4.4,终点时pH约为4,溶液由黄色变为橙色,且半分钟内不恢复为原来的颜色;
故答案为:3.1~4.4;溶液由黄色变为橙色,且半分钟内不恢复为原来的颜色;
(5)若酸式滴定管没有用标准H2SO4润洗,则标准液浓度变小,用量变大,
故答案为:偏高;
(7)滴到消耗的硫酸为:n(硫酸)=cV=(V2-V1)×10-3L×m mol/L,根据反应方程可知,n(NaOH)=2n(硫酸)=2m(V2-V1)×10-3mol,
所以原来样品中氢氧化钠的物质的量为:2m(V2-V1)×10-3mol×$\frac{250}{25}$=2m(V2-V1)×10-2mol,则样品中氢氧化钠的质量为m(NaOH)=nM=80m(V2-V1)×10-2g,则该烧碱样品的纯度为:$\frac{80M(V2-V1)×1{0}^{-2}g}{W}$×100%=$\frac{0.8M(V2-V1)}{W}$×100%,
故答案为:$\frac{0.8M(V2-V1)}{W}$×100%.
点评 本题综合考查酸碱中和滴定,侧重于化学实验基本操作以及物质的含量的测定等问题,题目难度中等,建议在学习中把握相关基本实验方法,学习中注意积累.


科目:高中化学 来源: 题型:选择题
| A. | ρ1>ρ2>ρ3>ρ4 | B. | ρ1>ρ2>ρ4>ρ3 | C. | ρ2>ρ1>ρ3>ρ4 | D. | ρ2>ρ1>ρ4>ρ3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据是否具有丁达尔效应,可将分散系分为溶液、浊液和胶体 | |
| B. | SiO2既能与NaOH溶液反应,又能与氢氟酸反应,但SiO2不属于两性氧化物 | |
| C. | AgCl的水溶液不易导电,故AgCl是弱电解质 | |
| D. | 烧碱、纯碱、熟石灰均属于碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑧ | B. | ②③⑥⑦ | C. | ①③⑥⑦ | D. | ①④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
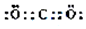 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:解答题
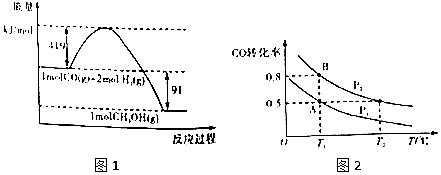
| 化学键 | H-H | H-O | O=O |
| 键能kj/mol | 436 | x | 496 |
| 容器 | 甲 | 乙 | 丙 |
| 相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
| 反应物投料 | 1molCO、2molH2 | 1molCH3OH | 1molCH3OH |
| 平衡时容器体积 | V(甲) | V(乙) | V(丙) |
| 反应的平衡常数K | K(甲) | K(乙) | K(丙) |
| 平衡时CH3OH的浓度/mol•L-1 | C(甲) | C(乙) | C(丙) |
| 平衡时CH3OH的反应速率/mol•L-1•min-1 | v(甲) | v(乙) | v(丙) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg(OH)2+2HCl═MgCl2+2H2O | B. | 2NaOH+H2SO4═Na2SO4+2H2O | ||
| C. | Ba(OH)2+H2SO4═BaSO4↓+2H2O | D. | CH3COOH+NaOH═CH3COONa+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com