
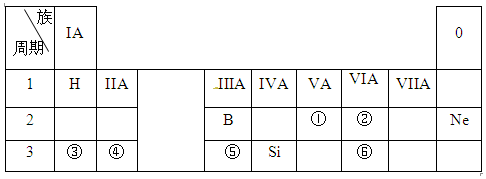
分析 由元素的位置可知,①②③④⑤⑥分别为N、O、Na、Mg、Al、S,
(1)①为N元素,元素①的最低价氢化物和最高价氧化物的水化物反应生成硝酸铵;
(2)同主族元素从上到下原子半径增大;
(3)同周期元素从左到右元素的金属性减弱,氢氧化铝为两性氢氧化物;
(4)镁和稀硫酸反应生成硫酸镁和氢气.
解答 解:由元素的位置可知,①②③④⑤⑥分别为N、O、Na、Mg、Al、S,
(1)①为N元素,元素①的最低价氢化物为氨气,和最高价氧化物的水化物硝酸反应生成硝酸铵,化学式为NH4NO3,故答案为:NH4NO3;
(2)同主族元素从上到下原子半径增大,则原子半径②<⑥,故答案为:<;
(3)同周期元素从左到右元素的金属性减弱,则金属性③>⑤,氢氧化铝为两性氢氧化物,氢氧化钠与氢氧化铝反应生成偏铝酸钠与水,反应离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:>;Al(OH)3+OH-=AlO2-+2H2O;
(4)④的单质与⑥的最高价氧化物对应水化物的稀溶液的反应为镁和稀硫酸的反应,反应的离子方程式为Mg+2H+=Mg2++H2↑,
故答案为:Mg+2H+=Mg2++H2↑.
点评 本题考查位置、结构、性质的关系,为高频考点,把握元素的位置推断元素及元素化合物知识为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 用饱和Na2CO3溶液除去SO2气体中含有的少量CO2 | |
| B. | 用加热的方法提取NH4Cl固体中混有的少量单质碘 | |
| C. | 用玻璃棒搅拌漏斗中的液体以加快过滤的速度 | |
| D. | 用醋和KI淀粉溶液检验食用加碘盐中含有的碘元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
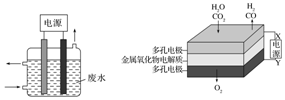 用图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,阳极的电极反应式为:Cl-+2OH--2e-═ClO-+H2O;
用图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,阳极的电极反应式为:Cl-+2OH--2e-═ClO-+H2O;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用溴水一种试剂可将苯、四氯化碳、己烯、乙醇、苯酚鉴别开 | |
| B. | 组成为 C4H10O 的醇与乙二酸可生成 10 种二元酯 | |
| C. | 含四个碳原子的有机物,氢原子个数一定为 10 个 | |
| D. | 芥子醇(如图)分子中所有碳原子可能在同一平面内,且与足量浓溴水反应最多消耗1molBr2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 用图所示装置进行下列各组实验,具体操作如下:将①中溶液滴入②中,预测的现象与实际相符的是( )
用图所示装置进行下列各组实验,具体操作如下:将①中溶液滴入②中,预测的现象与实际相符的是( )| 选项 | ①中物质 | ②中物质 | 预测的实验现象 |
| A | 浓盐酸 | 二氧化锰固体 | 立即产生气泡 |
| B | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
| C | 氯化铝溶液 | 浓氢氧化钠溶液 | 立即产生白色沉淀 |
| D | 稀硫酸 | 滴有石蕊的亚硫酸钠溶液 | 溶液逐渐变红 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com