
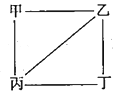
 X、Y、Z、W为原子序数递增的4种短周周期元素,其中Y、Z为金属元素.X、Y、Z、W的最高价氧化物对应的水化物甲、乙、丙、丁之间存在如下图所示反应关系(图中“一”相连的两种物质能发生反应).下列判断正确的是( )
X、Y、Z、W为原子序数递增的4种短周周期元素,其中Y、Z为金属元素.X、Y、Z、W的最高价氧化物对应的水化物甲、乙、丙、丁之间存在如下图所示反应关系(图中“一”相连的两种物质能发生反应).下列判断正确的是( )| A. | X是元素周期表中非金属性最强的元素 | |
| B. | Z位于元素周期表第3周期IA族 | |
| C. | 4种原子中,Y原子半径最小 | |
| D. | W的阴离子可能促进水的电离 |
分析 Y、Z为金属元素,对应的最高价氧化物对应的水化物可发生反应,则应为氢氧化铝和氢氧化钠的反应,可知Y为Na、Z为Al,乙为NaOH,丙为Al(OH)3,X应为N,甲为HNO3,W可为为S、Cl,则丁可能为H2SO4、HClO4,结合对应单质、化合物的性质以及元素周期率解答该题.
解答 解:由以上分析可知X为N、Y为Na、Z为Al、W为S或Cl,甲为HNO3,乙为NaOH,丙为Al(OH)3,丁为H2SO4或HClO4,
A.X为N,元素周期表中非金属性最强的元素为F,故A错误;
B.Z为Al,位于周期表第三周期ⅢA族,故B错误;
C.4种原子中,半径最小的为N,Y为Na,原子半径最大,故C错误;
D.如W为S,对应的离子为S2-,水解呈碱性,可促进水的电离,故D正确.
故选D.
点评 本题考查无机物的推断,为高频考点,侧重考查学生的分析能力,注意把握物质的性质以及转化关系,本题突破口为乙、丙的反应,难度不大.


科目:高中化学 来源: 题型:解答题
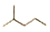 ,其分子式为C6H14,名称是2-甲基戊烷,它可由2种炔通过加成反应得到.
,其分子式为C6H14,名称是2-甲基戊烷,它可由2种炔通过加成反应得到.| 实验步骤 | 解 释 或 实 验 结 论 |
| (1)称取A 18.0g,升温使其汽化,测其密度是相同条件下H2的45倍. | ①A的相对分子质量为90. |
(2)A的核磁共振氢谱如图: | ②A中含有4种氢原子. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸与铜反应得到NO2、N2O4共23g,则铜失去的电子数为0.5NA | |
| B. | 10g 46%的乙醇水溶液中所含氢原子数目为0.6NA | |
| C. | 标准状况下8.96L的平均相对分子质量为3.5的H2与D2含有中子数0.3NA | |
| D. | 1molCu与足量的S完全反应,转移电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
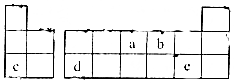
| A. | 气态氢化物的稳定性:a>b>c | |
| B. | 原子半径大小:a>b>c | |
| C. | c,d,e的氧化物对应的水化物之间两两皆能反应 | |
| D. | b、c形成的化合物中阴、阳离子的个数比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:r(N)>r(M)>r(Y)>r(X) | |
| B. | X与Y形成的化合物溶于水,溶液显碱性 | |
| C. | 简单气态氢化物的热稳定性:M>N>X | |
| D. | 单质的熔点:Y>N>M>X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
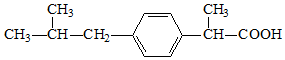
| A. | 布洛芬的分子式为C13H18O2 | |
| B. | 布洛芬与苯乙酸是同系物 | |
| C. | 1mol 布洛芬最多能与3mol 氢气发生加成反应 | |
| D. | 布洛芬在苯环上发生取代反应,其一氯代物有4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
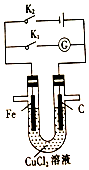
| A. | 同时打开K1、K2,铁棒上有紫红色物质析出 | |
| B. | 只闭合K1,石墨棒上有紫红色物质析出 | |
| C. | 只闭合K2,当电路中通过0.3mol电子时,两极共产生4.48L(标准状况)气体 | |
| D. | 只闭合K2,一段时间后,将电解质溶液搅拌均匀,溶液的pH变大(不考虑Cl2的溶解) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ).
).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com