
A.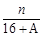 (A-N+8)mol (A-N+8)mol | B.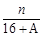 (A-N+10)mol (A-N+10)mol |
| C.(A-N+2)mol | D. (A-N+6)mol (A-N+6)mol |
科目:高中化学 来源:不详 题型:单选题

| A.若Y是Al(OH)3,则X可以是AlCl3或Na[Al(OH)4] |
| B.若a是铁单质,则X可以是氯气、溴单质或稀硝酸 |
| C.若Z是CO2,则X可以是碳酸钠 |
| D.若a是氧气,则X只可能是碳单质、硫单质或氮气 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A. (A+N+m)mol (A+N+m)mol | B. (A-N+m)mol (A-N+m)mol |
C. ( A-N)mol ( A-N)mol | D. (A-N)mol (A-N)mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原子序数是99 | B.质量数是43 | C.中子数是99 | D.电子数是43 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 4 molC和3 molX,10分钟后反应达到平衡,平衡时混合气体共6 mol,则下列说法正确的是
4 molC和3 molX,10分钟后反应达到平衡,平衡时混合气体共6 mol,则下列说法正确的是  提高C的转化率
提高C的转化率查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
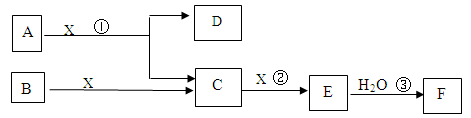
 J反应生成盐。W是前四周期含有4个未成对电
J反应生成盐。W是前四周期含有4个未成对电 子的金属。上述物质转化关系如图,部分产物和条件已略去。请回答下列问题:
子的金属。上述物质转化关系如图,部分产物和条件已略去。请回答下列问题: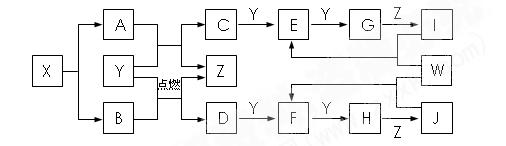
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com