
”¾ĢāÄæ”æijĶ¬Ń§Éč¼ĘŹµŃéÖ¤Ć÷ĶÓėÅØĮņĖįÄÜ·¢Éś·“Ó¦£¬²¢¼ģŃéÉś³ÉĘųĢåµÄŠŌÖŹ£¬ČēĶ¼ĖłŹ¾£¬ŌŚŹŌ¹ÜĄļ¼ÓČė2mLÅØĮņĖį£¬ÓĆ“ųµ¼¹ÜŗĶŅ»øöŠ”æ׵Ľŗ¹ÜČū½ō£¬“Óæ×ÖŠ²åČėŅ»øłĶĖ棬¼ÓČČ£¬°Ń·Å³öµÄĘųĢåŅĄ“ĪĶØČėĘ·ŗģČÜŅŗŗĶŹÆČļČÜŅŗÖŠ”£Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
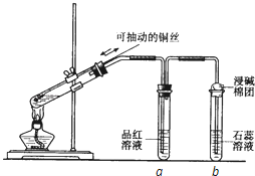
£Ø1£©Š“³öĶÓėÅØĮņĖį·“Ó¦µÄ»Æѧ·½³ĢŹ½£ŗ________”£
£Ø2£©ŹŌ¹Üa”¢b·Ö±š¼ģŃéÉś³ÉĘųĢåµÄŠŌÖŹ£¬Š“³ö¹Ū²ģµ½µÄĻÖĻó¼°Ęä×÷ÓĆ”£
ŹŌ¹ÜaÖŠµÄĻÖĻóŹĒ________£¬ ×÷ÓĆŹĒ________£»ŹŌ¹ÜbÖŠµÄĻÖĻóŹĒ________£¬×÷ÓĆŹĒ________”£
”¾“š°ø”æCu+2H2SO4£ØÅØ£©![]() CuSO4+2H2O+SO2”ü Ę·ŗģČÜŅŗĶŹÉ«Ö¤Ć÷¶žŃõ»ÆĮņ¾ßÓŠĘư׊Ō×ĻÉ«ŹÆČļŹŌŅŗ±äŗģÖ¤Ć÷¶žŃõ»ÆĮņČÜÓŚĖ®ĻŌŹ¾ĖįŠŌ
CuSO4+2H2O+SO2”ü Ę·ŗģČÜŅŗĶŹÉ«Ö¤Ć÷¶žŃõ»ÆĮņ¾ßÓŠĘư׊Ō×ĻÉ«ŹÆČļŹŌŅŗ±äŗģÖ¤Ć÷¶žŃõ»ÆĮņČÜÓŚĖ®ĻŌŹ¾ĖįŠŌ
”¾½āĪö”æ
£Ø1£©ĶÓėÅØĮņĖį·“Ӧɜ³ÉĮņĖįĶ”¢¶žŃõ»ÆĮņĘųĢåŗĶĖ®£¬¾Ż“ĖŠ“³ö·“Ó¦µÄ»Æѧ·½³ĢŹ½£»£Ø2£©¶žŃõ»ÆĮņ¾ßÓŠĘư׊Ō£¬Äܹ»Ź¹Ę·ŗģČÜŅŗĶŹÉ«£»¶žŃõ»ÆĮņĪŖĖįŠŌŃõ»ÆĪļ£¬ČÜÓŚĖ®ĻŌŹ¾ĖįŠŌ”£
£Ø1£©ĶøśÅØĮņĖį·“Ó¦£¬Ķ¾ßÓŠ»¹ŌŠŌ£¬ÅØĮņĖį¾ßÓŠĒæŃõ»ÆŠŌ£¬·“Ó¦±ŲŠė¼ÓČČ²ÅÄÜ·¢Éś£¬ŹéŠ“»Æѧ·½³ĢŹ½Ź±×¢Ņā”°ÅØ”±×Ö£¬·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗCu+2H2SO4£ØÅØ£©CuSO4+2H2O+SO2”ü£»£Ø2£©¶žŃõ»ÆĮņ¾ßÓŠĘư׊Ō£¬Äܹ»Ź¹Ę·ŗģČÜŅŗĶŹÉ«£¬ĖłŅŌŹŌ¹ÜaÖŠĘ·ŗģČÜŅŗĶŹÉ«£¬ÄæµÄŹĒÖ¤Ć÷¶žŃõ»ÆĮņ¾ßÓŠĘư׊Ō£»¶žŃõ»ÆĮņŹōÓŚĖįŠŌŃõ»ÆĪļ£¬ČÜÓŚĖ®ŗóČÜŅŗĻŌŹ¾ĖįŠŌ£¬Äܹ»Ź¹×ĻÉ«µÄŹÆČļŹŌŅŗ±äŗģ£¬¹Ź“š°øĪŖ£ŗĘ·ŗģČÜŅŗĶŹÉ«£»Ö¤Ć÷¶žŃõ»ÆĮņ¾ßÓŠĘư׊Ō£»×ĻÉ«ŹÆČļŹŌŅŗ±äŗģ£»Ö¤Ć÷¶žŃõ»ÆĮņČÜÓŚĖ®ĻŌŹ¾ĖįŠŌ”£


 ŌĶĮæģ³µĻµĮŠ“š°ø
ŌĶĮæģ³µĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ¾”¹ÜµŖŌŖĖŲŌŚµŲæĒÖŠµÄŗ¬Įæ½ĻµĶ£ØÖ÷ŅŖŅŌĻõĖįŃĪµÄŠĪŹ½“ęŌŚ£©£¬µ«ŹĒ“óĘųÖŠÓŠ·įø»µÄµŖĘų£¬ÕāĪŖ°±ŗĶĻõĖįµÄ¹ć·ŗÓ¦ÓĆĢį¹©ĮĖæÉÄÜ”£
£Ø1£©µŖĘųµÄµē×ÓŹ½ĪŖ________£¬Ą×µē×÷ÓĆÄܽųŠŠµŖµÄ¹Ģ¶Ø£¬Š“³ö·“Ó¦·½³ĢŹ½________”£
£Ø2£©Ź³ĪļŌĢŗ¬µÄÓŖŃųĪļÖŹÖŠ£¬ŗ¬µŖµÄøß·Ö×Ó»ÆŗĻĪļŹĒ_____£ØĢīĆū³Ę£¬ĻĀĶ¬£©£¬ĘäĖ®½āµÄ×īÖÕ²śĪļĪŖ________”£
£Ø3£©ĶĮČĄÖŠµÄNH4+ŌŚĻõ»ÆĻø¾śµÄ“ß»Æ×÷ÓĆĻĀæɱ»Ńõ»Æ³ÉNO3©£¬Š“³öĘäĄė×Ó·½³ĢŹ½£ŗ________”£
£Ø4£©Ä³Ć¾ĀĮŗĻ½šÓĆ×ćĮæĻ”ĻõĖįĶźČ«Čܽā£¬µĆµ½±ź×¼×“æöĻĀNO 11.2L£¬ŌŁĻņČÜŅŗÖŠ¼ÓČė¹żĮæ°±Ė®£¬³ä·Ö·“Ó¦ŗó¹żĀĖ£®Čō³ĮµķÖŹĮæĪŖ40.8g£¬ŌņŗĻ½šµÄÖŹĮæĪŖ________g”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ»ÆŗĻĪļÖŠ¼ČÄÜŹ¹äåµÄĖÄĀČ»ÆĢ¼ČÜŅŗĶŹÉ«£¬ÓÖÄÜŌŚ¹āÕÕĻĀÓėäå·¢ÉśČ”“ś·“Ó¦µÄŹĒ
A. ¼×±½ B. ŅŅ“¼ C. ±ūĻ© D. ŅŅĻ©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ£Ø1£©ŹµŃéŹŅÅäÖĘ1000mL0.50mol”¤L-1µÄNa2CO3ČÜŅŗ£¬ŌŚ³£ÓĆŅĒĘ÷֊ӦєÓĆ______mLµÄČŻĮæĘ棬³ĘĮæŹ±Čō½«·ØĀė·ÅŌŚ×óÅĢ£Ø1gŅŌĻĀÓĆÓĪĀė£©£¬ŌņÅäÖʵÄČÜŅŗµÄĪļÖŹµÄĮæÅضČ______0.50mol”¤L-1£ØĢī”°“óÓŚ”±”¢”°Š”ÓŚ”±»ņ”°µČÓŚ”±£©”£
£Ø2£©ÅäÖĘĶź±Ļŗó£¬ÓƱź×¼Na2CO3ČÜŅŗµĪ¶ØĪ“ÖŖÅØ¶ČµÄŃĪĖįŹ±£¬Na2CO3ČÜŅŗӦװŌŚ______Ź½µĪ¶Ø¹ÜÖŠ”£Čō²ÉÓĆÉĻŹö±ź×¼Na2CO3ČÜŅŗµĪ¶Ø£¬µĪ¶ØŹ±ŹµŃ鏿¾ŻĮŠ±ķČēĻĀ£ŗ
“ĪŹż±ąŗÅ | “ż²āŃĪĖįĢå»ż£ØmL£© | µĪČėNa2CO3ČÜŅŗĢå»ż£ØmL£© |
1 | 20.00 | 18.80 |
2 | 20.00 | 16.95 |
3 | 20.00 | 17.05 |
Ōņc(HCl)=______mol”¤L-1”£
£Ø3£©ČōŹ¢×°Na2CO3ČÜŅŗµÄµĪ¶Ø¹ÜŌŚµĪ¶ØĒ°Ī“ÓƱź×¼ŅŗČóĻ“£¬Ōņ×īŗóĖł²āŃĪĖįÅضČ______£¬ČōŌĄ“ÅäÖĘĖł³ĘČ”µÄNa2CO3¹ĢĢåÖŠ»ģÓŠNa2CO3”¤10H2O£¬ŌņŹµŃéĪó²īĪŖ______£ØŅŌÉĻĮ½æÕĢī”°Ę«øß”±”¢”°Ę«µĶ”±»ņ”°ĪŽÓ°Ļģ”±£©
£Ø4£©³£ĪĀĻĀĻņ20 mL 0.1 mol”¤L£1 Na2CO3ČÜŅŗÖŠÖšµĪ¼ÓČė0.1 mol”¤L£1 HClČÜŅŗ40 mL£¬ČÜŅŗpHÖš½„½µµĶ£¬“ĖŹ±ČÜŅŗÖŠŗ¬Ģ¼ŌŖĖŲµÄĪ¢Į£µÄĪļÖŹµÄĮæÅØ¶ČµÄ°Ł·Öŗ¬Įæ(ׯÖį)·¢ÉśµÄ±ä»Æ(CO2ŅņŅŻ³öĪ“»³ö)ČēĶ¼ĖłŹ¾£¬øł¾ŻĶ¼Ź¾»Ų“šĻĀĮŠĪŹĢā£ŗ

¢ŁĒėŠ“³öAB¶Ī·“Ó¦µÄĄė×Ó·½³ĢŹ½___________________________________
µ±·“Ó¦µ½AµćŹ±£¬ČÜŅŗÖŠĖłÓŠŃōĄė×ÓŗĶŅõĄė×ÓµÄÅØ¶Č“óŠ”¹ŲĻµĪŖ(ĀČĄė×ÓÅØ¶Č³żĶā)_____________________________________________________________________________
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĄė×Ó·½³ĢŹ½±ķ“ļÕżČ·µÄŹĒ£Ø £©
A. Ć÷·ÆČÜŅŗÖŠµĪ¼ÓBa(OH)2ČÜŅŗÖĮSO42£ĶźČ«³Įµķ£ŗAl3£«£«Ba2£«£«SO42££«3OH£=BaSO4”ż£«Al(OH)3”ż
B. ½«Ģś·Ū¼ÓČėµ½Ļ”ĮņĖįÖÖ£ŗ2Fe£«6H£«=2Fe3£«£«3H2”ü
C. ĮņĖįŃĒĢśĖįŠŌČÜŅŗÖŠ¼ÓČė¹żŃõ»ÆĒā£ŗ2Fe2£«£«H2O2£«2H£«=2Fe3£«£«2H2O
D. NaAlO2ČÜŅŗÖŠĶØČė¹żĮæµÄCO2£ŗ2AlO2££«3H2O£«CO2=2Al(OH)3”ż£«CO32£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”湤ŅµÉĻÓĆCOŗĶH2·“Ó¦Öʱø¶ž¼×ĆŃ(CH3OCH3)µÄĢõ¼žŹĒŃ¹Į¦2.0~10.0MPa£¬ĪĀ¶Č300”ę”£Éč±øÖŠ½ųŠŠĻĀĮŠ·“Ó¦£¬Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
¢ŁCO(g)+2H2(B)![]() CH3OH(g) ”÷H=-90.7kJ/mol
CH3OH(g) ”÷H=-90.7kJ/mol
¢Ś2CH3OH(g)![]() CH3OCH3(g)+H2O(g) ”÷H=-23.5kJ/mol
CH3OCH3(g)+H2O(g) ”÷H=-23.5kJ/mol
¢ŪCO(g)+H2O(g)![]() CO2(g)+H2(g) ”÷H=-41.2kJ/mol
CO2(g)+H2(g) ”÷H=-41.2kJ/mol
£Ø1£©×Ü·“Ó¦3CO(g)+3H2(g)=CH3OCH3(g)+CO2(g)µÄ”÷H=_____________ ”£¾Ż“ĖæÉÅŠ¶ĻøĆ·“Ó¦_________________Ģõ¼žĻĀ×Ō·¢”£
£Ø2£©ŌŚĪĀ¶ČŗĶČŻ»ż²»±äµÄĢõ¼žĻĀ·¢Éś·“Ó¦¢Ł£¬ÄÜĖµĆ÷øĆ·“Ó¦“ļµ½Ę½ŗāדĢ¬µÄŅĄ¾ŻŹĒ_____
a.ČŻĘ÷ÖŠŃ¹Ēæ±£³Ö²»±ä b.»ģŗĻĘųĢåÖŠc(CO)²»±ä
c.vÕż(CO)= vÄę(H2) d.c(CH3OH)= c(CO)
£Ø3£©ŌŚ2L µÄČŻĘ÷ÖŠ¼ÓČėamol CH3OH(g)·¢Éś·“Ó¦¢Ś£¬“ļµ½Ę½ŗāŗóČōŌŁ¼ÓČėamolCH3OH(g)ÖŲŠĀ“ļµ½Ę½ŗāŹ±£¬CH3OH µÄ×Ŗ»ÆĀŹ____________(Ģī”°Ōö“ó”±”¢”° ¼õŠ””±»ņ”°²»±ä”±)”£
£Ø4£©850”ꏱŌŚŅ»Ģå»żĪŖ10L µÄČŻĘ÷ÖŠĶØČėŅ»¶ØĮæµÄCOŗĶH2O(g)·¢Éś·“Ó¦¢Ū£¬COŗĶH2O(g)ÅØ¶Č±ä»ÆČēĶ¼ĖłŹ¾”£
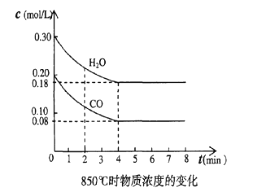
¢Ł0”«4min µÄĘ½¾ł·“Ó¦ĖŁĀŹ£¬v(CO)=________________ ”£
¢ŚČōĪĀ¶Č²»±ä£¬ĻņøĆČŻĘ÷ÖŠ¼ÓČė4mo1CO(g)”¢2mo1H2O(g)”¢3mo1CO2(g)ŗĶ3molH2(g)£¬ĘšŹ¼Ź±vÕż(CO)______vÄę(H2)(Ģī”°<”±”¢”° >”±»ņ”°=”±)£¬Ēė½įŗĻ±ŲŅŖµÄ¼ĘĖćĖµĆ÷ĄķÓÉ”£________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĪļÖŹŹōÓŚ·Ēµē½āÖŹµÄŹĒ( )
A.ĀČĘųB.“×ĖįC.°±ĘųD.ĀČ»Æļ§ČÜŅŗ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ³£ĪĀĻĀN2H4ĪŖŅŗĢ壬æÉ×÷ĪŖ»š¼ż·¢¶Æ»śµÄČ¼ĮĻ£¬ÓėŃõ»Æ¼ĮN2O4·¢Éś·“Ó¦£ŗ2N2H4 + N2O4 ![]() 3N2 + 4H2O”£·Ö×ÓĒņ¹÷Ä£ŠĶČēĻĀĶ¼ĖłŹ¾£¬NAĪŖ°¢·ü¼ÓµĀĀŽ³£ŹżµÄÖµ£¬ĻĀĮŠŠšŹöÕżČ·µÄŹĒ
3N2 + 4H2O”£·Ö×ÓĒņ¹÷Ä£ŠĶČēĻĀĶ¼ĖłŹ¾£¬NAĪŖ°¢·ü¼ÓµĀĀŽ³£ŹżµÄÖµ£¬ĻĀĮŠŠšŹöÕżČ·µÄŹĒ
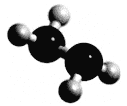
A. 32 g N2H4ÖŠŗ¬ÓŠ¹²ÓƵē×Ó¶ŌŹżĪŖ6 NA
B. ±ź×¼×“æöĻĀ£¬22.4L N2H4ÖŠŗ¬ÓŠµÄ·Ö×ÓŹżĪŖNA
C. N2H4ŗĶN2O4»ģŗĻµÄ×ÜĪļÖŹµÄĮæĪŖ1molŹ±£¬ŗ¬µŖŌ×ÓŹżĪŖ4 NA
D. ÉĻŹö·“Ó¦ĻūŗÄ1mol N2H4£¬×ŖŅʵē×ÓŹżĪŖ4 NA
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚŠĀÖĘĀČĖ®ÖŠ·Ö±š½ųŠŠĻĀĮŠŹµŃ飬Š“³öĻąÓ¦µÄŹµŃéĻÖĻó¼°·“Ó¦µÄĪ¢Į£”£
£Ø1£©ŌŚĀČĖ®ÖŠ¼ÓČėĆ¾Ģõ£¬ĻÖĻóĪŖ£ŗ________£¬·“Ó¦Ī¢Į£ŹĒ£ŗ________”£
£Ø2£©½«ĀČĖ®µĪ¼Óµ½AgNO3ČÜŅŗÖŠ£¬ĻÖĻóĪŖ£ŗ________£¬·“Ó¦Ī¢Į£ŹĒ£ŗ________”£
£Ø3£©½«ŗģ²¼Ģõ·ÅČėĀČĖ®ÖŠ£¬ĻÖĻóĪŖ£ŗ________£¬·“Ó¦Ī¢Į£ŹĒ£ŗ________”£
£Ø4£©ĀČĖ®ÖŠµĪ¼Ó×ĻÉ«ŹÆČļŹŌŅŗ£¬ĻÖĻóĪŖ£ŗ________£¬Ī¢Į£ŹĒ£ŗ________”£
£Ø5£©½«ĀČĖ®µĪ¼Óµ½FeCl2ČÜŅŗÖŠ£¬ĻÖĻóĪŖ£ŗ________£¬Ī¢Į£ŹĒ£ŗ________”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com