
分析 (1)根据n=$\frac{m}{M}$计算二者的物质的量之比,二者的物质的量之比等于其分子个数之比,根据分子构成计算氮原子和氧原子的个数比,该混合气体的平均摩尔质量=$\frac{m}{n}$;
(2)微粒mRn+核外有18个电子,则该离子质子数=18+n,中子数=m-(18+n),其摩尔质量=mg/mol,ag该微粒的物质的量=$\frac{ag}{mg/mol}$=$\frac{a}{m}$mol,则该微粒个数为$\frac{a}{m}$NA,根据微粒构成计算质子数及中子物质的量;
(3)根据V=$\frac{m}{M}{V}_{m}$知,同温同压下,质量相同的这几种气体,其体积与摩尔质量成反比,根据ρ=$\frac{M}{{V}_{m}}$知,其密度与摩尔质量成正比;
(4)VmLAl2(SO4)3溶液中含Al3+ag,则c(Al3+)=$\frac{\frac{ag}{27g/mol}}{(V×1{0}^{-3})L}$=$\frac{1000a}{27V}$mol/L,取$\frac{V}{4}$mL溶液稀释到VmL,则稀释后溶液中c(Al3+)为原来的$\frac{1}{4}$,所以稀释后溶液中c(Al3+)=$\frac{250a}{27V}$mol/L,铝离子与硫酸根离子的浓度之比等于其系数之比.
解答 解:(1)根据n=$\frac{m}{M}$计算二者的物质的量之比=$\frac{14}{28}$:$\frac{15}{30}$=1:1,二者的物质的量之比等于其分子个数之比,则二者的分子个数之比为1:1,根据分子构成知,混合气体中氮原子和氧原子的个数比=3:1,该混合气体的平均摩尔质量=$\frac{m}{n}$=$\frac{14+15}{\frac{14}{28}+\frac{15}{30}}$g/mol=29g/mol,
故答案为:1:1;3:1;29;
(2)微粒mRn+核外有18个电子,则该离子质子数=18+n,中子数=m-(18+n),其摩尔质量=mg/mol,ag该微粒的物质的量=$\frac{ag}{mg/mol}$=$\frac{a}{m}$mol,则该微粒个数为$\frac{a}{m}$NA,该微粒中质子数为$\frac{(18+n)a}{m}$NA,中子的物质的量为$\frac{(m-18-n)a}{m}$mol,
故答案为:$\frac{(18+n)a}{m}$NA;$\frac{(m-18-n)a}{m}$mol;
(3)根据V=$\frac{m}{M}{V}_{m}$知,同温同压下,质量相同的这几种气体,其体积与摩尔质量成反比,这几种气体摩尔质量大小顺序是⑤>①>③>④>②,所以其体积大小顺序是②>④>③>①>⑤,
根据ρ=$\frac{M}{{V}_{m}}$知,其密度与摩尔质量成正比,则其密度大小顺序是②>④>③>①>⑤,
故答案为:②>④>③>①>⑤;⑤>①>③>④>②;
(4)VmLAl2(SO4)3溶液中含Al3+ag,则c(Al3+)=$\frac{\frac{ag}{27g/mol}}{(V×1{0}^{-3})L}$=$\frac{1000a}{27V}$mol/L,取$\frac{V}{4}$mL溶液稀释到VmL,则稀释后溶液中c(Al3+)为原来的$\frac{1}{4}$,所以稀释后溶液中c(Al3+)=$\frac{250a}{27V}$mol/L,铝离子与硫酸根离子的浓度之比等于其系数之比,则稀释后c(SO42-)=$\frac{250a}{27V}$mol/L×$\frac{3}{2}$=$\frac{125a}{9V}$mol/L,
故答案为:$\frac{125a}{9V}$mol/L.
点评 本题考查物质的量有关计算,为高频考点,明确各个物理量的关系、微粒构成是解本题关键,熟练掌握物质的量有关公式并灵活运用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 油脂皂化生成的高级脂肪酸钠是肥皂的有效成分 | |
| B. | 重金属盐能使蛋白质变性,所以误食重金属盐会中毒 | |
| C. | 在入海口的钢铁闸门上装一定数量的铜块可防止闸门被腐蚀 | |
| D. | 禁止使用四乙基铅作汽油抗爆震剂,可减少汽车尾气污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何金属元素与非金属元素之间的化合 | |
| B. | 任意两种元素之间的化合 | |
| C. | 典型活泼金属和典型活泼非金属之间的化合 | |
| D. | 两种非金属元素之间的化合 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
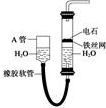 用图中的实验装置制取乙炔.
用图中的实验装置制取乙炔.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯和丙烷 | B. | 甲烷和丙烷 | C. | 甲烷和丙烯 | D. | 乙烯和丁烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA | |
| B. | 标准状况下,11.2L苯中含有分子的数目为0.5NA | |
| C. | 常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA | |
| D. | 物质的量浓度为1mol/L100mlHCl溶液中含0.1molHCl分子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com