
【题目】已知:2CH3OH(g)![]() CH3OCH3(g)+H2O(g) ΔH=-25 kJ/mol。某温度下的平衡常数为400。此温度下,在1 L的密闭容器中加入CH3OH,反应到某时刻测得各组分的物质的量浓度如下:
CH3OCH3(g)+H2O(g) ΔH=-25 kJ/mol。某温度下的平衡常数为400。此温度下,在1 L的密闭容器中加入CH3OH,反应到某时刻测得各组分的物质的量浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
c/(mol·L-1) | 0.8 | 1.24 | 1.24 |
下列说法正确的是( )
①平衡后升高温度,平衡常数>400
②平衡时,c(CH3OCH3)=1.6 mol/L
③平衡时,反应混合物的总能量减小20 kJ
④平衡时,再加入与起始等量的CH3OH,达新平衡后CH3OH转化率增大
⑤此时刻反应达到平衡状态
⑥平衡时CH3OH的浓度为0.08 mol·L-1
A. ①②④⑤ B. ②⑥ C. ②③④⑥ D. ②④⑥
【答案】B
【解析】
因为正反应为放热反应,升高温度平衡常数减小,①错;根据表格数据可知,反应转化生成的CH3OCH3、H2O浓度均为1.24 mol·L-1,此时CH3OH的浓度为0.8 mol·L-1,根据Qc=![]() ,将各物质的浓度代入可得,Qc=2.4<400,所以此时没有达到平衡,此时反应向正反应方向进行,⑤错;由化学平衡常数计算可知平衡时c(CH3OCH3)=1.6 mol/L,②对;生成CH3OCH3的物质的量为1.6 mol,根据方程式可知生成1.6 mol×25 kJ·mol-1=40 kJ,③错;平衡时,再加入与起始等量的CH3OH,相当于增大压强,平衡不移动,CH3OH的转化率不变,④错;根据②可知,达到平衡时CH3OH的浓度为0.8 mol·L-1-0.72 mol·L-1=0.08 mol·L-1,⑥对。
,将各物质的浓度代入可得,Qc=2.4<400,所以此时没有达到平衡,此时反应向正反应方向进行,⑤错;由化学平衡常数计算可知平衡时c(CH3OCH3)=1.6 mol/L,②对;生成CH3OCH3的物质的量为1.6 mol,根据方程式可知生成1.6 mol×25 kJ·mol-1=40 kJ,③错;平衡时,再加入与起始等量的CH3OH,相当于增大压强,平衡不移动,CH3OH的转化率不变,④错;根据②可知,达到平衡时CH3OH的浓度为0.8 mol·L-1-0.72 mol·L-1=0.08 mol·L-1,⑥对。


 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:
【题目】如图所示,将大烧杯丙扣在甲乙两个小烧杯(口向上)上。向两个小烧杯中分别装入如下表所列的试剂进行实验。实验现象与预测现象不同的是
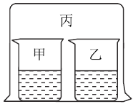
甲中试剂 | 乙中试剂 | 预测现象 | |
A | 浓盐酸 | 硝酸银溶液 | 乙中产生白色沉淀 |
B | 浓氨水 | 硫酸铁溶液 | 乙中产生红褐色沉淀 |
C | 浓盐酸 | 浓氨水 | 丙中产生白色烟雾 |
D | 氯化铝溶液 | 浓氨水并加入 固体氢氧化钠 | 甲中先产生白色沉淀,后又沉淀消失 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关钠及其化合物的叙述错误的是( )
A.Na2O2吸收CO2产生O2,可用作呼吸面具供氧剂
B.高压钠灯发出的黄光透雾能力强,可用于道路和广场照明
C.等质量NaHCO3和Na2CO3与盐酸完全反应,前者消耗盐酸较多
D.钠长期暴露在空气中的产物是Na2CO3,原因是钠与氧气生成的Na2O与水和CO2反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知,反应①:I2(aq)+I-(aq)![]() I3-(aq) △H1;反应②: I3-(aq)
I3-(aq) △H1;反应②: I3-(aq) ![]() I2(aq)+I-(aq) △H2;反应①的化学平衡常数K1与温度的关系如下表:
I2(aq)+I-(aq) △H2;反应①的化学平衡常数K1与温度的关系如下表:
t/℃ | 5 | 15 | 25 | 35 | 50 |
K1 | 1100 | 841 | 680 | 533 | 409 |
请回答:
(1)若反应②的化学平衡常数为K2,在相同温度下,K1·K2=____________。
(2)上述反应①的△H1_______0(填“>”、“=”、“<”);若升高温度,则I2的溶解速率会______(填“加快”、“减慢”或“不变”)。
(3)能判断反应①已达到平衡的依据是_______________
A.容器中的压强不再改变 B.溶液的颜色不再改变
C.I-浓度不再变化 D.正逆反应速率均为0
(4)某温度下,反应①的化学平衡常数为800。在该温度下,向甲、乙、丙三个容器中分别加入I2和I-,这两种物质的起始浓度如下:
起始浓度(mol/L) | 甲 | 乙 | 丙 |
c(I2) | 0.1 | 0.2 | 0.2 |
c(I-) | 0.2 | 0.1 | 0.2 |
反应速率最快的是_____________(填“甲”、“乙”或“丙”),平衡时I2的转化率最大的是__________(填“甲”、“乙”或“丙”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,加“碘”食盐较多的使用了碘酸钾(KIO3),碘酸钾在工业上可用电解法制取.以石墨和不锈钢为电极,以KI溶液为电解液,在一定条件下电解,反应方程式为:KI+3H2O![]() KIO3+3H2↑.下列有关说法正确的是( )
KIO3+3H2↑.下列有关说法正确的是( )
A. 电解时,石墨作阴极,不锈钢作阳极 B. 电解时阳极反应是:I﹣﹣6e﹣+3H2O=IO3﹣+6H+
C. 溶液调节至强酸性,对生产有利 D. 电解后溶液的pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用固体样品配制一定物质的量浓度的溶液,需经过称量、溶解、转移溶液、定容等操作。下列图示对应的操作规范的是(____)
A.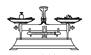 称量
称量
B.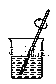 溶解
溶解
C.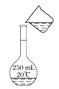 转移溶液
转移溶液
D.![]() 定容
定容
(2)下列几种导电性变化图像,把符合要求的图像序号填在相应的题目后面括号中。
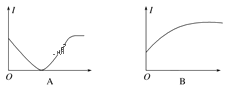
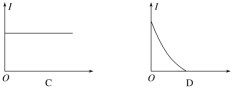
①向H2SO4溶液中加入等体积、等物质的量浓度的Ba(OH)2溶液(____)
②向AgNO3溶液通入少量HCl(____)
③向氨水中通入HCl直至过量(____)
④向饱和石灰水中不断通入CO2(____)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种将CO2和H2O转换为燃料H2、CO及CH4的装置如图所示(电解质溶液为稀H2SO4)。下列关于该装置的叙述错误的是
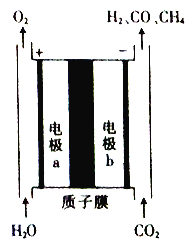
A. 该装置可将电能转化为化学能
B. 工作时,电极a周围溶液的pH增大
C. 电极b上生成CH4的电极反应式为CO2+8H++8e-===CH4+2H2O
D. 若电极b上只产生1 mol CO,则通过质子膜的H+数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知298 K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,取适量的MgCl2溶液,加入一定量的烧碱溶液达到沉淀溶解平衡,测得pH=13,则下列说法不正确的是( )
A. 所得溶液中的c(H+)=1.0×10-13mol·L-1
B. 所得溶液中由水电离产生的c(OH-)=1.0×10-13mol·L-1
C. 所加的烧碱溶液pH=13
D. 所得溶液中的c(Mg2+)=5.6×10-10mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡,根据要求回答下列问题:
(1)向 ZnSO4溶液中滴加饱和H2S溶液,没有沉淀生成,继续滴加一定量的氨水后,生成ZnS沉淀,用电离平衡原理解释上述现象 _______________________________________________ 。
(2)AlCl3溶液蒸干并灼烧得到的物质是__________ (填化学式)。
(3)0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为_____________。
(4)0.1mol·L-1的NaHA溶液中,粒子浓度由大到小的顺序为:c(Na+)>c(HA—)>c(H2A)>c(A2-)
①该溶液中显________(填“酸性”、“碱性”或“中性”);
②作出上述判断的依据是___________________________________________(用文字解释)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com