
科目:高中化学 来源: 题型:选择题
| A. | 建筑使用了大量钢材,钢材是纯铁 | |
| B. | 明矾与水反应生成氢氧化铝胶体能吸附水中悬浮物,可用于水的净化 | |
| C. | Al2O3的熔点很高,可用于制作耐高温材料 | |
| D. | 用焰色反应可鉴别K2CO3和NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
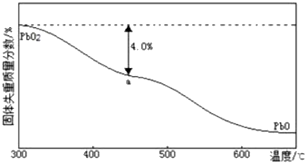
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的化学式为CuS,它既是氧化产物又是还原产物 | |
| B. | 5molFeS2发生反应,有10mol电子转移 | |
| C. | 产物中的SO42-有一部分是氧化产物 | |
| D. | FeS2只作还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol H2O的质量为18 g/mol | |
| B. | CH4的摩尔质量为16 g | |
| C. | 3.01×1023个SO2分子的质量为32 g | |
| D. | 标准状况下,1mol任何物质体积约为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2+、Na+、SO42-、Cl- | B. | Al3+、Na+、OH-、NO3- | ||
| C. | OH-、HCO3-、Ca2+、Na+ | D. | Mg2+、Na+、OH-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
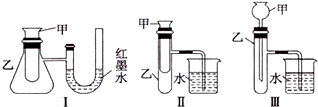
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 金属(块状) | 酸的浓度及体积 | 反应温度(℃) |
| A | Mg0.1mol | 6mol/L硝酸10mL | 70 |
| B | Mg0.2mol | 3mol/L盐酸40mL | 60 |
| C | Fe0.2mol | 3mol/L盐酸50mL | 60 |
| D | Mg0.1mol | 3mol/L硫酸10mL | 60 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
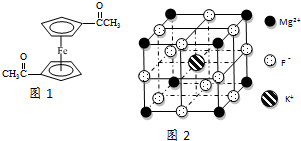
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com