
 ������Ҫ�Ļ���ԭ�ϣ�ij̽��С���������з�Ӧ��ȡˮ���£�N2H4•H2O����CO��NH2��+2NaOH+NaClO=Na2CO3+N2H4•H2O+NaCl
������Ҫ�Ļ���ԭ�ϣ�ij̽��С���������з�Ӧ��ȡˮ���£�N2H4•H2O����CO��NH2��+2NaOH+NaClO=Na2CO3+N2H4•H2O+NaCl���� ��1������ͨ�뵽ʢ��NaOH����ƿ�з�����Ӧ�����Ȼ��ơ��������ƺ�ˮ��
��2����N2H4•H2O+2NaClO=N2��+3H2O+2NaCl����֪ˮ���£�N2H4•H2O�����л�ԭ�ԣ��ױ���������������
��3��ˮ���������Һ��Ӧ����������ԭ��Ӧ�����ɵ������⻯���ˮ��NaHCO3�ܿ�����Һ��pH��6.5���ң�����Ϊ̼�����ƺ͵⻯�ⷴӦ��
��4����ˮ����ǿ�����ԣ��ܸ�ʴ��ʽ�ζ��ܵ������ݷ���ʽ����ˮ���µ����ʵ�������������������������
��� �⣺��1������ͨ�뵽ʢ��NaOH����ƿ�з�����Ӧ�����Ȼ��ơ��������ƺ�ˮ����Ӧ�����ӷ���ʽΪ��Cl2+2OH-=ClO-+Cl-+H2O��
�ʴ�Ϊ��Cl2+2OH-=ClO-+Cl-+H2O��
��2����N2H4•H2O+2NaClO=N2��+3H2O+2NaCl����֪ˮ���£�N2H4•H2O�����л�ԭ�ԣ��������������Һװ����ƿ�У���Ӧ���ɵ�ˮ���»ᱻ���������������ʷ�Һ©���е���Һ��NaOH��NaClO�����Һ��
�ʴ�Ϊ��A���������������Һװ����ƿ�У���Ӧ���ɵ�ˮ���»ᱻ��������������
��3��ˮ���������Һ��Ӧ����������ԭ��Ӧ�����ɵ������⻯���ˮ����Ӧ�Ļ�ѧ����ʽΪ��N2H4•H2O+2I2=N2��+4HI+H2O��NaHCO3�ܿ�����Һ��pH��6.5���ң�����Ϊ̼�����ƺ͵⻯�ⷴӦ��
�ʴ�Ϊ��N2H4•H2O+2I2=N2��+4HI+H2O�����ɵ�HI��NaHCO3��Ӧ��
��4���ⵥ�ʾ��������ԣ��ܸ�ʴ��ʽ�ζ��ܵ������ˮӦװ����ʽ�ζ����У�
N2H4•H2O+2I2=N2��+4HI+H2O��
1 2
n 0.2000mol/L��0.018L
n=0.0018mol
250ml��Һ�к��е����ʵ���=0.0018mol��$\frac{250mL}{25mL}$=0.018mol��
ˮ���£�N2H4•H2O������������=$\frac{0.018mol��50g/mol}{5.00g}$��100%=18.0%
�ʴ�Ϊ����ʽ��18.0%��
���� ���⿼���������Ʊ������ʵ�ʵ�顢�ζ�Ӧ�õȣ�ע��Ȼ���֪ʶ�����������Ӧ�ã���Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1mol | B�� | 2mol | C�� | 3mol | D�� | 4mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1molNH3���6.02��1024������ | |
| B�� | 1molˮ�к���2mol���1mol�� | |
| C�� | 1molOH-���8mol���� | |
| D�� | 2.3g����ԭ�ӱ������ʱ��ʧȥ�ĵ�����Ϊ0.1NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
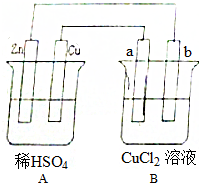
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
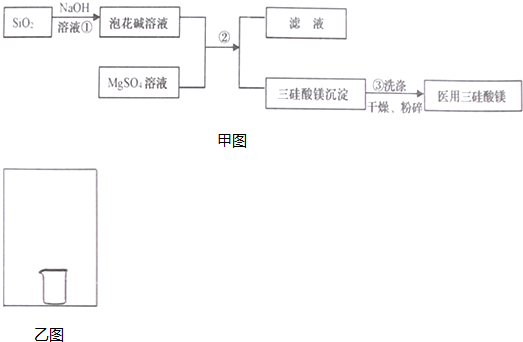
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
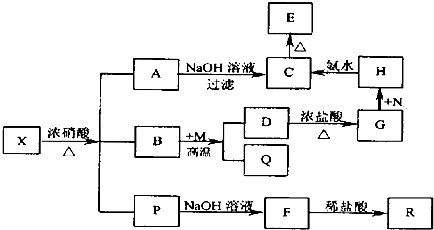
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ܶȱȿ���С | B�� | ����ɫ��ζ������ | ||
| C�� | ��ʹ�������ɫ������ɫ | D�� | ����NaOH��Һ��Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����������Һ��ϡ���ᷴӦ��Ba2++SO42-+H++OH-=BaSO4��+H2O | |
| B�� | ���۵⻯����Һ�ڿ����б�����4I-+O2+2H2O=4OH-+2I2 | |
| C�� | �����������������Fe2O3+6H+=2Fe3++3H2O | |
| D�� | �ð�ˮ����������SO2���壺OH-+SO2=HSO3- |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com