
| A. | 若Zn和MnO2都是足量的,则前一反应中盐酸全部被还原,后一反应中盐酸部分被氧化 | |
| B. | 两个都是氧化还原反应 | |
| C. | 盐酸都是被还原 | |
| D. | 等物质的量的Zn和MnO2分别与足量的浓盐酸反应,转移的电子数相等 |
分析 反应4HCl+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑中,Cl元素化合价升高,被氧化,HCl为还原剂,Mn元素化合价降低,被还原,MnO2为氧化剂,反应2HCl+Zn=ZnCl2+H2↑中,H元素化合价降低,被还原,HCl为氧化剂,Zn元素化合价升高,被氧化,Zn为还原剂,据此分析.
解答 解:A、反应4HCl+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑中,部分Cl元素化合价升高,所以盐酸部分被氧化,反应2HCl+Zn=ZnCl2+H2↑中,H元素化合价降低,则全部被还原被还原,故A正确;
B、反应4HCl+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑和反应2HCl+Zn=ZnCl2+H2↑中,都有化合价变化,所以都是氧化还原反应,故B正确;
C、反应4HCl+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑中,部分Cl元素化合价升高,所以盐酸部分被氧化,故C错误;
D、反应4HCl+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑和反应2HCl+Zn=ZnCl2+H2↑中,等物质的量的Zn和MnO2分别反应,生成1mol氢气和1mol氯气,所以转移的电子数相等,故正确;
故选:C.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念的考查,注意从化合价角度分析,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:2:2 | B. | 1:2:3 | C. | 1:3:3 | D. | 3:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
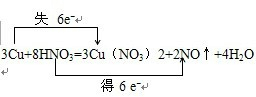 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
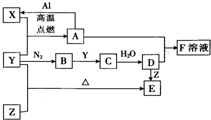 已知X、Y、Z为单质,其它为化合物.其中Y为气体,F溶液呈黄色,E是常见的温室气体,它们之间存在如下的转化关系(部分产物已经略去).请回答下列问题:
已知X、Y、Z为单质,其它为化合物.其中Y为气体,F溶液呈黄色,E是常见的温室气体,它们之间存在如下的转化关系(部分产物已经略去).请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 逆反应速率增大,正反应速率减小 | B. | 逆反应速率减小,正反应速率增大 | ||
| C. | 逆反应速率先增大后减小 | D. | 正反应速率先减小后增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平均相对分子质量 | B. | 密度 | ||
| C. | 容器内的压强 | D. | 物质的量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com