
| A. | 0.1 mol•L-1氨水中c$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-8,则c(H+)=1×10-11 mol•L-1 | |
| B. | pH=7的NH4Cl和NH3•H2O的混合溶液:c(Cl-)>c(NH4+)>c(H+)=c(OH-) | |
| C. | 在0.1 mol•L-1(NH4)2C2O4溶液中:c(NH4+)=2[c(C2O42-)+c(HC2O4-)+c(H2C2O4)] | |
| D. | 浓度均为0.1 mol•L-1的硫酸氢铵溶液与氢氧化钠溶液等体积混合:c(SO42-)=c(Na+)>c(NH4+)>c(H+)>c(OH-) |
分析 A.溶液中存在离子积常数,结合离子浓度比计算得到氢离子浓度;
B.溶液中存在电荷守恒,pH=7的NH4Cl和NH3•H2O的混合溶液中c(H+)=c(OH-);
C.在0.1 mol•L-1(NH4)2C2O4溶液中存在物料守恒,n(C)=n(N),碳元素所有存在形式2倍和氮元素所有存在形式浓度相同;
D.浓度均为0.1 mol•L-1的硫酸氢铵溶液与氢氧化钠溶液等体积混合,二者反应生成等浓度的硫酸铵、硫酸钠,硫酸根离子与钠离子浓度相等,c(SO42-)=c(Na+);
解答 解:A.常温下溶液中c(H+)×c(OH-)=10-14,$\frac{c({H}^{+})}{c(O{H}^{-})}$=10-8,计算得到c(H+)=1×10-11 mol•L-1 ,故A正确;
B.溶液中存在电荷守恒,c(NH4+)+c(H+)=c(OH-)+c(Cl-),pH=7的NH4Cl和NH3•H2O的混合溶液中c(H+)=c(OH-),则c(Cl-)=c(NH4+),混合溶液中存在:c(Cl-)=c(NH4+)>c(H+)=c(OH-),故B错误;
C.在0.1 mol•L-1(NH4)2C2O4溶液中存在物料守恒:c(NH4+)+c(NH3•H2O)=2[c(C2O42-)+c(HC2O4-)+c(H2C2O4)],故C错误;
D.浓度均为0.1mol•L-1的硫酸氢铵溶液与氢氧化钠溶液等体积混合,反应生成等浓度的硫酸铵和硫酸钠,则c(SO42-)=c(Na+),铵根离子部分水解,溶液呈酸性,c(H+)>c(OH-),溶液中正确的离子浓度大小为:c(SO42-)=c(Na+)>c(NH4+)>c(H+)>c(OH-),故D正确;
故选AD.
点评 本题考查了电解质溶液中离子浓度大小比较,主要是电荷守恒、物料守恒的分析应用,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
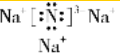 ,该化合物是离子化合物(选填“离子”、“共价”).
,该化合物是离子化合物(选填“离子”、“共价”).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体熔点由低到高:CCl4<CBr4<CI4<CF4 | |
| B. | 硬度由大到小:金刚石>晶体硅>碳化硅 | |
| C. | 熔点由高到低:Na>Mg>Al | |
| D. | 晶格能由大到小:NaF>NaCl>NaBr>NaI |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
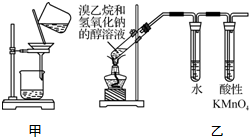
| A. | 用玻璃棒蘸取氯水点在干燥的pH试纸上,测定该溶液的pH | |
| B. | 称取4.0 g NaOH,放入100 mL容量瓶中,加水稀释,配制1.0 mol•L-1的NaOH溶液 | |
| C. | 用甲装置分离Cl2与KI溶液反应生成的碘 | |
| D. | 用乙装置检验溴乙烷与NaOH醇溶液共热产生乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化石燃料燃烧和工业废气中的氮氧化物是导致“雾霾天气”的原因之一 | |
| B. | 铝制餐具不宜长时间存放酸性、碱性和咸的食物 | |
| C. | 用含有铁粉的透气小袋与食品一起密封包装来防止食品氧化 | |
| D. | 化学药品着火,都要立即用水或泡沫灭火器灭火 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 误食重金属盐引起人体中毒,可喝大量的食盐水解毒 | |
| B. | 石油的分馏、煤的干馏、石油的裂解都是化学变化 | |
| C. | 陶瓷、砖瓦、玻璃、水泥等,都是硅酸盐产品 | |
| D. | 钢铁制品和铜制品既能发生吸氧腐蚀又能发生析氢腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
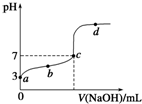 在某温度下,向20mL 0.1mol/L 某一元酸HA溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中一定正确的是( )
在某温度下,向20mL 0.1mol/L 某一元酸HA溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中一定正确的是( )| A. | a点表示溶液中c(A-)为0.1 mol/L | |
| B. | a、b、c、d点表示的溶液中一定有:c(H+)•c(OH-)=1×10-14 | |
| C. | c点表示HA和NaOH恰好反应完全 | |
| D. | b、d点表示的溶液中,其$\frac{c({H}^{+})•c({A}^{-})}{c(HA)}$值一定不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com