
 .
.
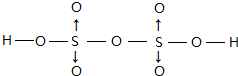 (配位键须注明).
(配位键须注明).
分析 (1)钒的核电荷数为23,则可以推知钒在元素周期表中的位置为第4周期ⅤB族,根据核外电子的轨道能量排布顺序知,1s<2s<2p<3s<3p<4s<3d<4p,因此推断其电子排布式为1s22s22p63s23p63d34s2,注意由于4s轨道能量比3d轨道能量低,因此先排4s轨道,V失去最外层的2个电子后,3d上再失去1个电子得到V3+,因此V3+价电子排布式为3d2,以此书写电子排布图;
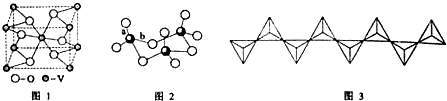
(2)由晶胞可知,V位于顶点和体心,O有4个位于面心,2个位于体心,用均摊法计算;
(3)SO2分子中S原子形成2个δ键,孤电子对数为 $\frac{6-2×2}{2}$=1,则SO2分子空间构型为V形,孤对电子的排斥作用力强,键角应小于120°;SO3的三聚体中S原子形成4个δ键,为sp3杂化;SO3的三聚体中每个S形成S=O键和S-O键,S=O键长较短,即a较短,该分子中含有σ键数目为3×4=12;
(4)VO43-中,V形成4个δ键,孤电子对数为 $\frac{5+3-4×2}{2}$=0,为正四面体结构,与VO43-空间构型相同的一种阳离子和一种阴离子是NH4+、SO42-,由链状结构可知每个V与3个O形成阴离子,且V的化合价为+5价,以此判断形成的化合物的化学式;
(5)含氧酸H2S2O7属于二元酸,其结构中所有原子都达到稳定结构,且不存在非极性键,不存在氧原子之间、S原子之间形成的共价键,故S原子与氧原子之间形成共价键,O原子与H原子之间形成共价键,且每个S提供孤对电子与2个O原子形成2个配位键;
(6)分子内氢键的存在,导致水溶性减小,据此解答即可.
解答 解(1)钒的核电荷数为23,则可以推知钒在元素周期表中的位置为第四周期ⅤB族,根据核外电子的轨道能量排布顺序知,1s<2s<2p<3s<3p<4s<3d<4p,因此推断其电子排布式为1s22s22p63s23p63d34s2,注意由于4s轨道能量比3d轨道能量低,因此先排4s轨道,V失去最外层的2个电子后,3d上再失去1个电子得到V3+,因此V3+价电子排布式为3d2,价电子排布图为 ,
,
故答案为:第四周期ⅤB族; ;
;
(2)由晶胞可知,V位于顶点和体心,阳离子个数为1+8×$\frac{1}{8}$=2,O有4个位于面心,2个位于体心,则阴离子个数为4×$\frac{1}{2}$+2=4,则晶体的化学式为:VO2,
故答案为:VO2;
(3)SO2分子中S原子形成2个δ键,孤电子对数为 $\frac{6-2×2}{2}$=1,则SO2分子空间构型为V形,孤对电子的排斥作用力强,键角应小于120°;SO3的三聚体中S原子形成4个δ键,为sp3杂化;SO3的三聚体中每个S形成S=O键和S-O键,S=O键长较短,即a较短,该分子中含有σ键数目为3×4=12,
故答案为:<;a;12;
(4)VO43-中,V形成4个δ键,孤电子对数为 $\frac{5+3-4×2}{2}$=0,为正四面体结构,与VO43-空间构型相同的一种阳离子和一种阴离子是NH4+、SO42-,由链状结构可知每个V与3个O形成阴离子,且V的化合价为+5价,则形成的化合物化学式为NaVO3,
故答案为:正四面体;NH4+、SO42-;NaVO3;
(5)含氧酸H2S2O7属于二元酸,已知其结构中所有原子都达到稳定结构,且不存在非极性键,不存在氧原子之间、S原子之间形成的共价键,故S原子与氧原子之间形成共价键,O原子与H原子之间形成共价键,且每个S提供孤对电子与2个O原子形成2个配位键,其结构式为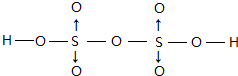 ,
,
故答案为: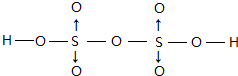 ;
;
(6)由于M能形成分子内氢键,使溶解度减小,
故答案为:M能形成分子内氢键,使溶解度减小.
点评 综合考查物质的结构和性质,涉及价电子排布图、微粒结构、晶胞结构与计算、配合物、空间构型等,侧重于学生的分析能力的考查,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:实验题
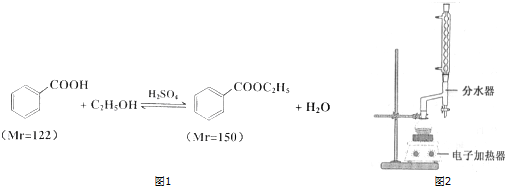
| 颜色、状态 | 沸点(℃) | 密度(g•cm-3) | |
| 苯甲酸* | 无色、片状晶体 | 249 | 1.2659 |
| 苯甲酸乙酯 | 无色澄清液体 | 212.6 | 1.05 |
| 乙醇 | 无色澄清液体 | 78.3 | 0.7893 |
| 环己烷 | 无色澄清液体 | 80.8 | 0.7318 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 高锰酸钾是一种重要的化学试剂,其溶液不很稳定,在酸性条件下会分解生成二氧化锰和氧气,在中性或弱碱性溶液中分解速度很慢,见光分解速度加快.
高锰酸钾是一种重要的化学试剂,其溶液不很稳定,在酸性条件下会分解生成二氧化锰和氧气,在中性或弱碱性溶液中分解速度很慢,见光分解速度加快.滴入高锰酸钾溶液的次序(每滴溶液的体积相同) | 高锰酸钾溶液紫色褪去的时间 |
| 先滴入第1滴 | 1min |
| 褪色后再滴入第2滴 | 15s |
| 褪色后再滴入第3滴 | 3s |
| 褪色后再滴入第4滴 | 1s |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)=c(HA-)+2c(A2-)+c(OH-) | |
| B. | c(H2A)+c(HA-)+c(A2-)=0.1 mol•L-1 | |
| C. | 将上述溶液稀释至0.01mol/L,c(H+)•c(OH-) 不变 | |
| D. | c (A2-)+c (OH-)=c (H+)+c (H2A) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
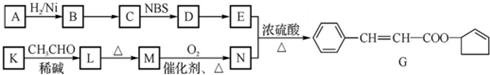
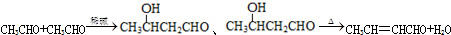
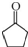 ,D中官能团的名称为碳碳双键、溴原子.
,D中官能团的名称为碳碳双键、溴原子. .
.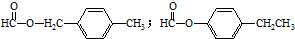 .
.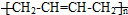 )的合成路线:CH3CH2CH2CH2OH$→_{△}^{浓硫酸}$CH3CH2CH=CH2$\stackrel{NBS}{→}$CH3CHBrCH=CH2$→_{△}^{NaOH醇溶液}$CH2=CHCH=CH2
)的合成路线:CH3CH2CH2CH2OH$→_{△}^{浓硫酸}$CH3CH2CH=CH2$\stackrel{NBS}{→}$CH3CHBrCH=CH2$→_{△}^{NaOH醇溶液}$CH2=CHCH=CH2 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
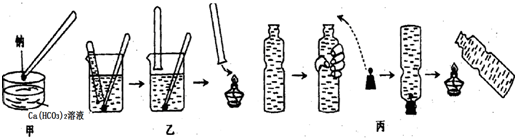
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

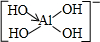 ,并推测1mol NH4BF4(氟硼酸铵)中含有2NA个配位键.
,并推测1mol NH4BF4(氟硼酸铵)中含有2NA个配位键.
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
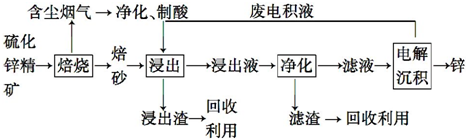
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com