
 .
.
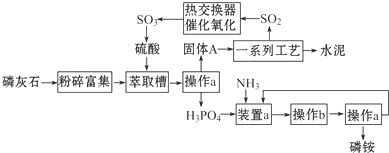
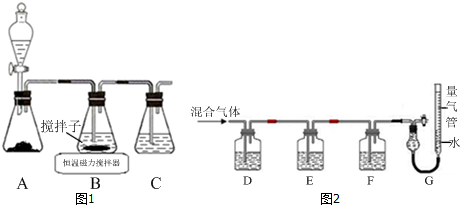
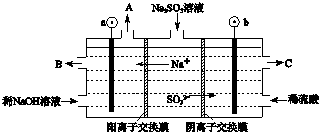
分析 磷灰石粉碎富集后,在萃取槽中用硫酸酸化得到硫酸钙与磷酸,过滤分离得到固体A为石膏与磷酸.装置a中磷酸与氨气发生反应,可以生成(NH4)3PO4、(NH4)2HPO4、NH4H2PO4,操作b是由溶液中析出晶体,应萃取蒸发浓缩、冷却结晶等操作,铵盐受热容易分解,在结晶时应采用低温蒸发结晶.在经过过滤分离得到磷酸铵,分离得到滤液进行循环利用,石膏经过一系列工艺得到水泥,得到二氧化硫等气体,气体处理后在热交换器中发生催化氧化得到三氧化硫,三氧化硫转化为硫酸,再循环利用,
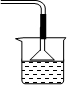
(1)磷酸和氨气极易反应,会产生倒吸的危险;
(2)冷凝管能实现气、液热交换;
(3)由信息可知生产磷铵排放的废渣磷石膏制取硫酸,磷灰石的主要成分是Ca3(PO4)2,在萃取槽中与硫酸发生反应,有磷酸生成,结合流程中硫酸制备,故固体A应为CaSO4;
(4)①二氧化硫在接触室中被氧化成三氧化硫,化学方程式为2SO2+O2$\frac{\underline{催化剂}}{△}$2SO3,该反应为放热反应,升高温度,平衡逆向移动,不利于提高三氧化硫的产率;
②2SO2+O2$\frac{\underline{催化剂}}{△}$2SO3为可逆反应,从提高产率和环境保护角度分析;
③通过吸收塔C后,混合气体中SO3含量较多,分析对2SO2+O2$\frac{\underline{催化剂}}{△}$2SO3平衡移动的影响;
④1吨20%的发烟硫酸中含SO3的质量为0.2t,加水后可生成H2SO40.245t,即硫酸的总质量为1.045t,换算为98%的浓硫酸质量为1.045t÷98%=1.066t.
(5)SO2、微量的SO3和酸雾都能与碱反应,不能利用碱测定,SO2具有还原性,可以利用强氧化剂测定.
解答 解:(1)磷酸和氨气极易反应,为防止反应过于迅速会产生倒吸的危险,要采用防倒吸装置,装置a图为:
故答案为; ;
;
(2)能实现气、液热交换的装置是冷凝管,下口进水伤口处谁,气体和水流方向相反,故答案为:冷凝管;
(3)由信息可知生产磷铵排放的废渣磷石膏制取硫酸,磷灰石的主要成分是Ca3(PO4)2,在萃取槽中与硫酸发生反应,有磷酸生成,结合流程中硫酸制备,故固体A应为CaSO4.
故答案为:CaSO4;
(4)①二氧化硫在接触室中被氧化成三氧化硫,化学方程式为2SO2+O2$\frac{\underline{催化剂}}{△}$2SO3,该反应为放热反应,升高温度,平衡逆向移动,不利于提高三氧化硫的产率,因此应选择等温过程,
故答案为:接触室;2SO2+O2$\frac{\underline{催化剂}}{△}$2SO3;等温过程;
②2SO2+O2$\frac{\underline{催化剂}}{△}$2SO3为可逆反应,二次催化使尚未反应的SO2尽量催化氧化成SO3,可以降低成本提高原料利用率和保护环境,
故答案为:该反应为可逆反应,二次催化使尚未反应的SO2尽量催化氧化成SO3,可以降低成本提高原料利用率和保护环境;
③通过吸收塔C后,混合气体中SO3含量较多,由2SO2+O2$\frac{\underline{催化剂}}{△}$2SO3可知,不利于平衡正向移动,
故答案为:通过吸收塔C后,混合气体中SO3含量较多,不利于SO2的催化氧化反应进行;
④1吨20%的发烟硫酸中含SO3的质量为0.2t,硫酸为0.8t,加水后可生成H2SO40.245t,即硫酸的总质量为1.045t,换算为98%的浓硫酸质量为$\frac{1.045t}{98%}$=1.066t,故加入的水的质量为0.066t,
故答案为:0.066;
(5)A、NaOH溶液与SO2、微量的SO3和酸雾反应,测量的SO2含量偏高,故A错误;
B、硫酸尾气中只有SO2能被酸性KMnO4溶液氧化,溶液颜色由紫红色变为无色,根据KMnO4溶液的体积结合方程式计算SO2的含量,故B正确;
C、硫酸尾气中只有SO2能被碘水氧化SO2,溶液颜色由蓝色变为无色,根据碘水溶液的体积结合方程式计算SO2的含量,故C正确;
D、氨水NaOH溶液与SO2、微量的SO3和酸雾反应,测量的SO2含量偏高,故D错误.
故答案为:BC.
点评 本题考查了化学工业生产流程的分析、实验操作以及产物的判断和计算,综合性强,为高考高频考点,掌握工业制取硫酸、磷铵的原理和流程是解题的关键,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 8.0gCuO和Cu2S的混合物含铜原子个数为0.2NA | |
| B. | 标准状况下,11.2 L乙醇蒸气含共价键数目为4NA | |
| C. | 1mol K与O2完全反应生成K2O、K2O2、KO3的混合物,转移电子数为NA | |
| D. | 1L 0.2 mol•L-1 NH4ClO4溶液中含NH4+数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
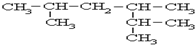
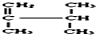 系统名称为2,3-二甲基-1-丁烯;
系统名称为2,3-二甲基-1-丁烯; ≡C-CH=CH-CH3,共面的碳原子最多有12个,共线的碳原子最多有6个.
≡C-CH=CH-CH3,共面的碳原子最多有12个,共线的碳原子最多有6个. 表示的分子式C6H14.
表示的分子式C6H14.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ① | ② | ③ | ④ |
| 0.1mol/L NaOH溶液 | pH=11 NaOH溶液 | 0.1mol/L CH3COOH溶液 | pH=3 CH3COOH溶液 |
| A. | 由水电离出H+的浓度c(H+):①>③ | |
| B. | 将④加蒸馏水稀释至原来的100倍时,所得溶液的pH=5 | |
| C. | ①与③混合,若溶液pH=7,则体积V(NaOH)>V(CH3COOH) | |
| D. | 将②与④等体积混合,各离子浓度的关系为:c(CH3COO-)+c(OH-)=c(Na+)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
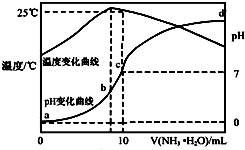 在某温度时,将n mol•L-1氨水滴入10mL 1.0mol•L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示,下列有关说法正确的是( )
在某温度时,将n mol•L-1氨水滴入10mL 1.0mol•L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示,下列有关说法正确的是( )| A. | a点Kw=1.0×10-14 | |
| B. | 水的电离程度:b>c>a>d | |
| C. | b点:c(NH4+)>c(Cl-)>c(H+)>c(OH-) | |
| D. | 25℃时NH4Cl水解常数为(n-1)×10-7 mol•L-1(用n表示) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com