
| A、热稳定性:PH3<SiH4<NH3<HF | B、微粒直径大小:S2->Cl->Mg2+>Al3+ | C、酸性强弱:盐酸>乙酸>碳酸>次氯酸 | D、熔点高低:石墨>食盐>干冰>液溴 |


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源:2013-2014学年安徽省高三第三次月考化学试卷(解析版) 题型:实验题
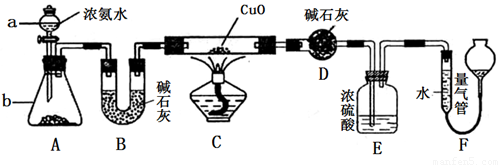
某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:
(1)仪器a的名称为________;仪器b中可选择的试剂为________;

(2)实验室中利用下列各组物质,进行喷泉实验,不能成功的是( )
A.Cl2与饱和食盐水 B.CO2 与40%的NaOH溶液
C.NH3与饱和食盐水 D.HCl与水
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,上述现象证明NH3具有还原性,写出相应的化学方程式______________________________ .
(4)E装置中浓硫酸的作用_______________________
(5)实验完毕,若测得干燥管D增重mg,装置F测得气体的体积为nL(已折算成标准状况),则氨分子中氮、氢的原子个数比为________(用含m、n字母的代数式表示)
查看答案和解析>>
科目:高中化学 来源:2014届安徽省高三上学期段一考试化学试卷(解析版) 题型:实验题
某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:
(1) 仪器a的名称为________;仪器b中可选择的试剂为________;
(2)实验室中利用下列各组物质,进行喷泉实验,不能成功的是 。
A.Cl2与饱和食盐水 B.CO2 与40%的NaOH溶液
C.NH3与饱和食盐水 D.HCl与水
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,上述现象证明NH3具有________性,写出相应的化学方程式 。
(4)E装置中浓硫酸的作用________________________________。
(5)实验完毕,若测得干燥管D增重mg,装置F测得气体的体积为nL(已折算成标准状况),则氨分子中氮、氢的原子个数比为________(用含m、n字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:
(1) 仪器a的名称为________;仪器b中可选择的试剂为________;

(2) 实验室中利用下列各组物质,进行喷泉实验,不能成功的是
A. Cl2与饱和食盐水 B. CO2 与40%的NaOH溶液
C. NH3与饱和食盐水 D. HCl与水
(3) 实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,上述现象证明NH3具有________性,写出相应的化学方程式
(4)E装置中浓硫酸的作用________________________________
(5)实验完毕,若测得干燥管D增重mg,装置F测得气体的体积为nL(已折算成标准状况),则氨分子中氮、氢的原子个数比为________(用含m、n字母的代数式表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com