
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
由乙炔制CHClBr—CH2Br,下列方法中最可行的是
( )
A.先与HBr加成后再与HCl加成
B.先与H2完全加成后再与Cl2、Br2发生取代反应
C.先与HCl加成后再与Br2加成
D.先与Cl2加成后再与HBr加成
查看答案和解析>>
科目:高中化学 来源: 题型:
香豆素类化合物具有抗病毒、抗癌等多种生物活性,香豆素-3-羧酸可由水杨醛制备。

下列说法正确的是
A.水杨醛分子中所有原子可能处于同一平面上
B.香豆素-3-羧酸能使酸性高锰酸钾溶液褪色
C.中间体X易溶于水
D.l mol水杨醛最多能与3 molH2发生
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:

其中CO的制备原理:HCOOH CO↑+H2O,并设计出原料气的制备装置(如下图)
CO↑+H2O,并设计出原料气的制备装置(如下图)

请填写下列空白:
(1)实验室现有锌粒、稀硝酸、稀盐酸、浓硫酸、2-丙醇,从中可以选择合适的试剂制备氢气、丙烯。写出制备丙烯的化学方程式: 。
(2)若用以上装置制备干燥纯净的CO,装置中a的作用是 ,装置中b的作用是
,c中盛装的试剂是 。
(3)制丙烯时,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是 (填序号)
①饱和Na2SO3溶液 ②酸性KMnO4溶液 ③石灰水 ④无水CuSO4 ⑤品红溶液
(4)正丁醛经催化加氢得到含少量正丁醛的1-丁醇粗品,为纯化1-丁醇,该小组查阅文献得知:
①R—CHO+NaHSO3(饱和) RCH(OH)SO3Na↓;②沸点:乙醚34℃,1-丁醇118℃,并设计出如下提纯路线:
RCH(OH)SO3Na↓;②沸点:乙醚34℃,1-丁醇118℃,并设计出如下提纯路线:

试剂1为 ,操作2为 ,操作3为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.H2O2、Cl2都具有很强的氧化性,在反应中只能做氧化剂
B.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl-
C.14C可用于文物的年代鉴定,14C与12C中所含质子数不同
D.有单质参加或生成的反应一定属于氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
已知常温下在溶液里可发生如下两个离子反应:
Ce4++Fe2+===Fe3++Ce3+
Sn2++2Fe3+===2Fe2++Sn4+
由此可以确定Fe3+、Ce4+、Sn4+三种离子的氧化性由强到弱的顺序
A.Sn4+、Fe3+、Ce4+ B.Ce4+、Fe3+、Sn4+
C.Sn4+、Ce4+、Fe3+ D.Fe3+、Sn4+、Ce4 +
+
查看答案和解析>>
科目:高中化学 来源: 题型:
某厂废水中含5.00×10-3 mol·L-1的Cr2O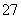 ,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4(Fe的化合价依次为+3、+2),设计了如下实验流程:
,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4(Fe的化合价依次为+3、+2),设计了如下实验流程:

(1)第①步反应的离子方程式是___________________________________________
____________________________________________________ ____________________。
____________________。
(2)第②步过滤得到的滤渣中主要成分除Cr(OH)3外,还有__________。
(3)欲使1 L该废水中的Cr2O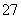 完全转化为Cr0.5Fe1.5FeO4。理论上需要加入________g FeSO4·7H2O。
完全转化为Cr0.5Fe1.5FeO4。理论上需要加入________g FeSO4·7H2O。
查看答案和解析>>
科目:高中化学 来源: 题型:
SO2是硫酸工业尾气的主要成分。实验室中,拟用如图所示流程,测定标准状况下体积为V L的硫酸工业尾气中SO2的含量。

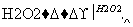

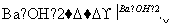


(1)步骤①中加入H2O2溶液时发生反应的离子方程式为____________________,1 mol H2O2参加反应,转移的电子数为________。
(2)步骤③的操作依次是过滤、________、________、称重。
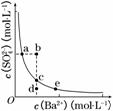
(3)一定温度下,BaSO4的沉淀溶解平衡曲线如图所示。步骤②逐滴加入Ba(OH)2溶液的过程中,BaSO4的溶度积常数________(填“增大”、“减小”或“不变”),溶液中SO 浓度的变化情况为________(填序号)。
浓度的变化情况为________(填序号)。
①d→c→e ②b→c→d ③a→c→e ④d→c→a
(4)该V L尾气中SO2的体积分数为________(用含有V、m的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com