
| A | B | C | D | E | G | |
| 最低化合价 | -4 | -2 | -1 | -2 | -1 | -3 |
| 电负性 | 2.55 | 2.58 | 3.16 | 3.44 | 3.98 | 3.0 |
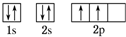 C原子的价电子排布式3s23p5
C原子的价电子排布式3s23p5分析 A、B、C、D、E五种短周期元素,根据元素化合价知,A属于第ⅣA族,B、D属于第ⅥA族,C、E属于第VⅡA族,G为第VA族,B的电负性小于D,所以D是O元素,B是S元素;C的电负性小于E,所以C是Cl元素,E是F元素,而G的电负性比硫大,所以G是N,结合问题(3)中AD2分子,所以A是C元素,结合物质的结构、性质解答.
解答 解:(1)A是6号碳元素,核外电子排布的轨道表示式为: ,C原子是氯原子,氯原子的价电子排布式:3s23p5,故答案为:
,C原子是氯原子,氯原子的价电子排布式:3s23p5,故答案为: ;3s23p5;
;3s23p5;
(2)元素非金属性越强,最高价氧化物对应的水化物的酸性越强,C、S、Cl、N中电负性最强的是Cl,所以非金属性最强的是氯,所以氯的最高价氧化物的水化物酸性最强,对应的酸为:HClO4,故答案为:HClO4;
(3)相同条件下,CO2与SO2分子在水中的溶解度,根据相似相溶的原理,二氧化碳是非极性分子,而二氧化硫是极性分子,溶剂水是极性分子,所以二氧化硫在水中的溶解度大于二氧化碳在水中的溶解度,故答案为:SO2;CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶”,SO2在H2O中的溶解度较大;
(4)A、B、D形成的氢化物分别是CH4、H2S和H2O,其中水分子之间形成氢键,沸点最高,而氧元素的非金属性最强,所以水分子最稳定,故答案为:H2O;H2O; (5)根据等电子原理,一氧化碳与氮气是等电子体,所以两者结构相似,所以一氧化碳的结构式为:C≡O,故答案为:C≡O;
(6)HCN分子中有C与N形成叁键和一个碳氢单键,所以2个σ键与2 个π键,所以HAG分子中σ键与π键数目之比为1:1,故答案为:1:1.
点评 本题考查原子原子核外电子的排布、等电子体、物质的溶解性等知识点,根据元素周期律、等电子体的概念、“相似相溶”原理来分析解答即可,难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 5:4 | C. | 4:3 | D. | 5:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 试管中加入少量苯,加入溴水振荡后,溴水褪色,发生了加成反应 | |
| B. | 苯能使酸性高锰酸钾溶液褪色 | |
| C. | 苯较难发生加成反应,所以通常要加入催化剂 | |
| D. | 苯不能发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
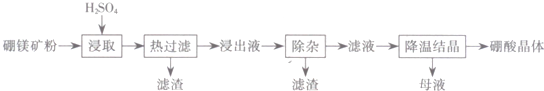
| 温度℃) | 20 | 40 | 60 | 100 |
| 溶解度(g) | 5.0 | 8.7 | 14.8 | 40.2 |
| 物质 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| pH | 3.2 | 5.2 | 9.7 | 12.4 |
| 化学式 | H2CO3 | CH3COOH |
| 电离常数 | K1=4.4×10-7 K2=4.7×10-11 | K=1.75×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
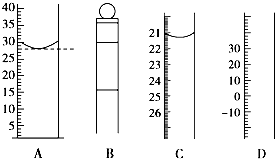 (1)图为常见仪器的部分结构(有的仪器被放大)
(1)图为常见仪器的部分结构(有的仪器被放大)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com