
| A、过量的浓盐酸与MnO2反应 |
| B、过量的Zn与18 mol/L的硫酸反应 |
| C、过量的Fe与稀硝酸反应 |
| D、过量的H2与N2在催化剂存在下反应 |


科目:高中化学 来源: 题型:
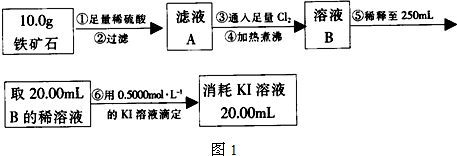

| 棉球 | 棉球上滴加的试剂 | 实验现象 | 解释和结论 |
| a | 棉球变白,微热后又恢复红色 | ||
| b | 含酚酞的NaOH溶液 | 棉球变为白色 | 离子方程式: |
| c | 棉球变为白色 | 结论:该气体具有 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 催化剂 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某温度下,在2L密闭容器中X、Y、Z三种物质(均为气态)间进行反应,其物质的量随时间的变化曲线如图.依图回答:
某温度下,在2L密闭容器中X、Y、Z三种物质(均为气态)间进行反应,其物质的量随时间的变化曲线如图.依图回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
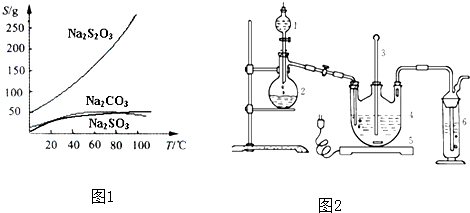
| ||
| 活性炭脱色 |
| 并保温 |
| 操作① |
| 蒸发浓缩 |
| 冷却晶体 |
| 操作② |
| 编号 | 1 | 2 | 3 | 4 |
| 消耗Na2S2O3标准溶液的体积/mL | 18.02 | 17.98 | 18.00 | 20.03 |
查看答案和解析>>
科目:高中化学 来源: 题型:
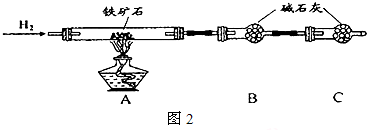
 用如图所示的收集装置收集氨气时,由于气流略强使得在试管底部形成气旋,导致氨气与空气混合而不能收集到纯氨气.现在有一小团棉花,请问将棉花放在试管那个位置可以阻止气旋?请说明理由.
用如图所示的收集装置收集氨气时,由于气流略强使得在试管底部形成气旋,导致氨气与空气混合而不能收集到纯氨气.现在有一小团棉花,请问将棉花放在试管那个位置可以阻止气旋?请说明理由.查看答案和解析>>
科目:高中化学 来源: 题型:
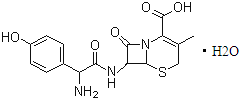
| A、头孢羟氨苄的化学式为C16H16N3O5S?H2O |
| B、1mol头孢羟氨苄与NaOH溶液和浓溴水反应时,分别需要消耗NaOH 4mol和Br2 3mol |
| C、在催化剂存在的条件下,1mol头孢羟氨苄消耗7molH2 |
| D、头孢羟氨苄在空气中能稳定存在 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com