
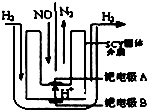
 汽车尾气中NOx的消除及无害化处理引起社会广泛关注.
汽车尾气中NOx的消除及无害化处理引起社会广泛关注.分析 (1)根据已知反应和盖斯定律,可得目标反应的△H;
(2)根据在钯电极A的反应物和生成物,可知发生还原反应,利用守恒配平即得电极反应式;
(3)二氧化氮中N的化合价为+4价,NO中N元素的化合价为+2价,反应生成一种盐,则只能生成+3价的NaNO2,反应的化学方程式为:NO2+NO+2NaOH=2NaNO2+H2O,然后改写成离子方程式即可;根据二氧化氮、一氧化氮和氢氧化钠反应的方程式中各个物理量之间的关系式计算;
(4)A.这几种铵盐溶液中,碳酸根离子促进铵根离子水解、亚铁离子抑制铵根离子水解,铵根离子水解程度越大,相同c(NH4+)的溶液中溶质的浓度越大;
B.常温下,等体积的pH=13的NaOH溶液和pH=1的HNO2溶液混合,溶液呈酸性;
C.氯化铵溶液呈酸性,要使溶液呈碱性,溶质应该还有一水合氨,所以溶质应该为NH4Cl、NH3.H2O;
D.NH4Cl受热易分解;
E.草木灰中碳酸钾溶液中水解显碱性,氯化铵溶液中铵根离子水解显酸性,二者混合水解相互促进损失肥效;
F.当△G=△H-T•△S<0时,反应能自发进行;
(5)依据铵根离子水解分析回答;依据同粒子效应,一水合氨对铵根离子水解起到抑制作用;依据一水合氨的电离平衡常数计算得到氨水浓度;
(6)反应到达平衡状态时,正逆反应速率相等,平衡时各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,由此进行判断;根据压强对化学平衡移动的影响来回答判断,平衡常数指各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,化学平衡常数只与温度有关,温度不变平衡常数不变.
解答 解:(1)根据已知反应:N2(g)+O2(g)=2NO(g)△H1=+180.5kJ/mol-----①
2H2(g)+O2(g)=2H2O(g)△H2=-483.6kJ/mol-----②
根据盖斯定律,则反应2H2(g)+2NO(g)=2H2O(g)+N2(g)可由②-①得到,则△H=△H2-△H1=-664.1kJ/mol,
故答案为:-664.1kJ/mol;
(2)在钯电极A,NO 转化为N2 ,发生还原反应,故为阴极,根据已知反应物和生成物,利用守恒配平即得电极反应式为2NO+4H++4e-=N2 +2H2O,
故答案为:阴;2NO+4H++4e-=N2↑+2H2O;
(3)NO2中N的化合价为+4价,NO中N元素的化合价为+2价,反应生成一种盐和水,则只能生成+3价的NaNO2,该反应的化学方程式为:NO2+NO+2NaOH=2NaNO2+H2O,改写成离子方程式为:NO2+NO+2OH-=2NO2-+H2O,设原混合气体中NO2和NO的物质的量n和m,
NO2+NO+2NaOH→2NaNO2+H2O,
1 1 2
mmol mmol 2mmol
2NO2+2NaOH=NaNO2 +NaNO3 +H2O,
2 1 1
(n-m)mol $\frac{(n-m)mol}{2}$ $\frac{(n-m)mol}{2}$ 所得溶液中c(NO3-):c(NO2-)=$\frac{(n-m)mol}{2}$:[$2m+\frac{(n-m)mol}{2}$]=1:9,所以n:m=3:2,
故答案为:NO2+NO+2OH-=2NO2-+H2O; 3:2;
(4)A.(NH4)2SO4、(NH4)2CO3、(NH4)2Fe (SO4)2三种溶液中,碳酸根离子促进铵根水解,亚铁离子抑制铵根离子水解,相同浓度的这几种溶液中铵根离子浓度大小是(NH4)2Fe (SO4)2>(NH4)2SO4>(NH4)2CO3>NH3•H2O,则如果 (NH4)2SO4、(NH4)2CO3、(NH4)2Fe (SO4)2、溶液中c (NH4+)相等,铵根离子水解程度越大,相同c(NH4+)的溶液中溶质的浓度越大,则这几种溶液的浓度大小顺序是c[(NH4)2CO3]>c[(NH4)2SO4]>c[(NH4)2Fe(SO4)2],故A错误;
B.亚硝酸不完全电离,溶液中存在电离平衡,常温下,等体积的pH=13的NaOH溶液和pH=1的HNO2溶液混合,亚硝酸电离出的氢离子能完全中和氢氧化钠电离出的氢氧根离子,亚硝酸电离平衡右移,溶液呈酸性,c(NO2-)>c(Na+)>c(H+)>c(OH-),故B错误;
C.某溶液中只存在OH-、H+、Cl-、NH4+四种离子,其离子浓度c(NH4+)>c(Cl-)>c(OH-)>c(H+),氯化铵溶液呈酸性,要使溶液呈碱性,溶质应该还有一水合氨,所以溶质应该为NH4Cl、NH3•H2O,一水合氨的电离大于水解,所以c(NH3•H2O)+c(NH4+)>c(Cl-),故C正确;
D.NH4Cl受热易分解,应采用冷却热NH4Cl饱和溶液制备NH4Cl晶体,故D错误;
E.当施肥时草木灰(有效成分为K2CO3)与NH4Cl混合使用,则二者的水解作用相互促进,使N元素以氨气的形式逸出因而肥效会降低,故E正确;
F.反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,△G=△H-T•△S<0,•△S<0,则该反应的△H<0,故F正确;
故选CEF;
(5)NO2可用氨水吸收生成NH4NO3.25℃时,将a mol NH4NO3溶于水,溶液显酸性,是因为铵根离子水解;反应的离子方程式为:NH4++H2O?NH3•H2O+H+;加入氨水溶液抑制铵根离子水解,平衡逆向进行;将a mol NH4NO3溶于水,向该溶液滴加b L 氨水后溶液呈中性,依据电荷守恒计算可知,溶液中氢氧根离子浓度=10-7mol/L,c(NH4+)=c(NO3-);NH3•H2O的电离平衡常数取Kb=2×10-5 mol•L-1,设混合后溶液体积为1L,(NH4+)=c(NO3-)=amol/L;根据一水合氨电离平衡得到:NH3•H2O?NH4++OH-,平衡常数K=$\frac{c(N{{H}_{4}}^{+})c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$=$\frac{amol/L×1{0}^{-7}mol/L}{bL×c(N{H}_{3}•{H}_{2}O)mol/L}$=2×10-5 mol•L-1,计算得到c(NH3•H2O)=$\frac{a}{200b}$mol/L,
故答案为:NH4++H2O?NH3•H2O+H+;逆向;$\frac{a}{200b}$;
(6)A.2v(NH3)═v(CO2),不能说明正逆反应速率相等,不一定是平衡状态,故A错误;
B.反应是一个前后系数和变化的反应,密闭容器中总压强不变,证明达到了平衡状态,故B正确;
C.密闭容器中混合气体的密度ρ=$\frac{m}{V}$,质量不守恒,分子变化,V不变,容器中总密度不变,证明达到了平衡状态,故C正确;
D.密闭容器中氨气的体积分数不变,不能证明达到平恒状态,故D错误.
若在恒温下压缩容器体积,则会将压强增大,平衡向左移动,固体质量增大,同一反应,平化学衡常数只受温度影响,非温度改变的平衡移动,平衡常数不变,
故答案为:BC;增大;不变.
点评 本题考查了反应热的计算、氧化还原反应的计算、化学平衡的影响因素分析,平衡标志的判断理解,平衡常数的影响因素和计算应用,弱电解质溶液中的电离平衡的计算应用、离子浓度大小比较等,综合性大,题目难度较大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
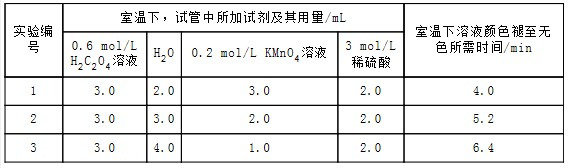
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 3 mol/L 稀硫酸 | 0.05 mol/L KMnO4溶液 | |||
| 4 | 3.0 | 2.0 | 2.0 | 3.0 | t | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该氧化物是含有非极性键的离子化合物 | |
| B. | 晶体的化学式为Ba2O2 | |
| C. | 该晶体晶胞结构与CsCl相似 | |
| D. | 晶体中Ba2+的配位数为8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 乙醇和乙酸发生酯化反应时断键② | |
| B. | 乙醇和金属钠的反应断键① | |
| C. | 乙醇和浓硫酸,共热到170℃时断键②⑤ | |
| D. | 乙醇在Cu催化作用下与O2反应时断键①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L甲醇中含有的氧原子数为1.0NA | |
| B. | 常温常压下,46gNO2与 N2O4的混合气体中含有的原子总数为3NA | |
| C. | 标准状况下,2.24LCl2与足量的稀NaOH溶液反应,转移电子总数为0.2NA | |
| D. | 1L 1 mol•L-1的盐酸中,所含氯化氢分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 25 | T1 | T2 |
| 水的离子积常数 | 1×10-14 | a | 1×10-12 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com