
| A. | ④⑤ | B. | ②④ | C. | ①② | D. | ③⑤ |
分析 ①胶体是混合物;
②弱电解质包括弱酸、弱碱和少部分盐以及水;
③Al2O3既能和酸反应又能和碱反应生成盐和水;
④由两种或以上物质构成的是混合物;
⑤有机高分子化合物是相对分子质量在1万以上的物质.
解答 解:①胶体是混合物,而硅酸是纯净物,故不是胶体,而氯化铁溶液是溶液,不是胶体,故错误;
②弱电解质包括弱酸、弱碱和少部分盐以及水,HI为强酸,故不是弱电解质,故错误;
③Al2O3既能和酸反应又能和碱反应生成盐和水,是两性氧化物,故错误;
④由两种或以上物质构成的是混合物,而明矾、冰醋酸、四氧化三铁均由一种物质构成,故为纯净物,故正确;
⑤有机高分子化合物是相对分子质量在1万以上的物质,而葡萄糖和油脂的相对分子质量均小于一万,故不是高分子化合物,故正确.
故选A.
点评 本题考查了常见的物质的分类方法,应注意的是胶体属于分散系,故是混合物,并掌握常见的强电解质和弱电解质,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:实验题
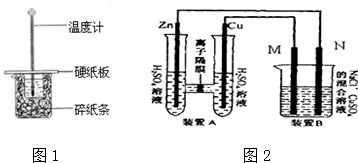
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
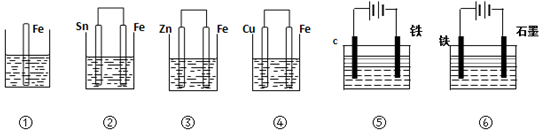
| A. | ④>②>①>③>⑤>⑥ | B. | ⑥>④>②>①>③>⑤ | C. | ④>②>⑤>③>⑥>① | D. | ⑥>③>②>④>①>⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用丁达尔效应可鉴别FeCl3溶液和Fe(OH)3胶体 | |
| B. | 在某未知成分的溶液中滴入足量盐酸,如观察到无色无味的气体产生,且能使澄清石灰水变浑浊,即证明溶液中必定有CO32- | |
| C. | 向某无色溶液中加入BaCl2溶液,有白色沉淀出现,再加入稀盐酸,沉淀不消失,无法证明溶液一定含有SO42- | |
| D. | 氨气能使湿润的红色石蕊试纸变蓝,说明氨气的水溶液呈碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫原子的原子结构示意图: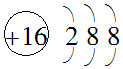 | |
| B. | NH4Cl的电子式: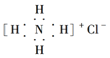 | |
| C. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O | |
| D. | HBr的形成过程: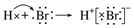 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Co2O3+6HCl=2CoCl2+Cl2↑+3H2O中,氧化剂和还原剂物质的量之比为1:6 | |
| B. | 5KI+KIO3+3H2SO4=3I2+3K2SO4+3H2O中,氧化产物和还原产物物质的量之比为5:1 | |
| C. | 3S8+24KOH=8K2SO3+4K2S4+12H2O中,被氧化和被还原的S8物质的量之比为2:1 | |
| D. | 3(NH4)2SO4=3SO2+N2+6H2O+4NH3中,反应中发生氧化反应和未发生氧化反应的氮元素物质的量之比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
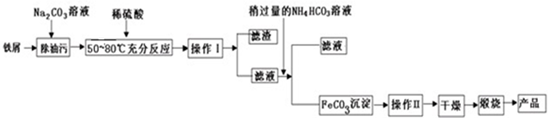
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com