
| V |
| Vm |
| n |
| V |
| 11.2L |
| 22.4L/mol |
| 0.5mol |
| 0.5L |


科目:高中化学 来源: 题型:
| A、CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 |
| B、将纯水加热至较高温度,水的离子积变大、pH变小、呈中性 |
| C、N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,反应速率v(H2)和H2的平衡转化率均增大 |
| D、水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 操作 | 现象 | 结论 |
| A | 常温下将铁片分别放在浓硝酸和稀硝酸中 | 在浓硝酸中无明显变化,稀硝酸中有气泡 | 稀硝酸的氧化性比浓硝酸强 |
| B | 将一小块Na放入无水乙醇中 | 产生气泡 | Na能置换出醇羟基中的氢 |
| C | 将水蒸气通过灼热的铁粉 | 铁粉变成红棕色粉末 | 铁与水在高温下发生反应 |
| D | 常温下将Al片放入浓硫酸中 | 无明显变化 | Al与浓硫酸不反应 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
 设反应①Fe(s)+CO2(g)?FeO(s)+CO(g)的平衡常数为K1.
设反应①Fe(s)+CO2(g)?FeO(s)+CO(g)的平衡常数为K1.| T(K) | K1 | K2 |
| 973 | 1.47 | 2.36 |
| 1173 | 2.15 | 1.67 |
查看答案和解析>>
科目:高中化学 来源: 题型:
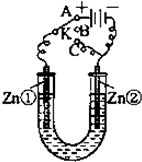 在一个U形管里盛有氯化铜溶液,并插入两块纯锌片作电极,如图所示:
在一个U形管里盛有氯化铜溶液,并插入两块纯锌片作电极,如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
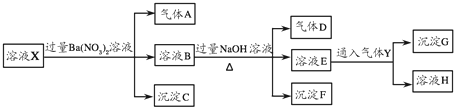
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com