
����Ŀ�����������漰ǰ 20 ��Ԫ�أ��밴Ҫ������Ӧ�Ļ�ѧ��������
��1������������������ 2 ����Ԫ��_____
��2���������������ڲ��������һ���ҵ��ʿ���Ϊ�缫���ϵ�Ԫ�أ� �������ڱ��е�λ����_____
��3��ԭ�Ӱ뾶���Ķ�����Ԫ�غ͵ؿ��к�������Ԫ���γ�ԭ�Ӹ�����Ϊ 1:1 �Ļ�����������ӷ���Ϊ________________________________
��4���������������۴�����Ϊ��Ķ�����Ԫ�أ�������������������Ԫ�������ȶ�����̬�⻯���ˮ��Һ�䷢����Ӧ�Ļ�ѧ����ʽ___________________________
��5����������Ԫ���У������Ӱ뾶��С��Ԫ�أ������ӽṹʾ��ͼΪ_____
��6�������� Xn+�� Yn-������ͬ�ĵ��Ӳ�ṹ��X n+����ɫΪ����ɫ���� Y ������������Ӧˮ���������Ϊ_____
���𰸡�C��S ��������IA �� O22- SiO2+ 4HF = SiF4��+2H2O ![]() ������
������
��������
��1������������������ 2 ����Ԫ����̼����Ԫ�أ�
��2���������������ڲ��������һ�룬���ʿ���Ϊ�缫���ϵ�Ԫ�أ���Ԫ��Ϊ���������Ԫ�أ�
��3��ԭ�Ӱ뾶���Ķ�����Ԫ����Na���ؿ��к�������Ԫ����O��
��4���������������۴�����Ϊ��Ķ�����Ԫ������A���C��Si �������������ֱ���CO2��SiO2��������Ԫ�������ȶ�����̬�⻯����HF��
��5����������Ԫ���У������Ӱ뾶��С��Ԫ����Al��
��6��X n+����ɫΪ����ɫ��X��KԪ�أ�������K+�� Y-������ͬ�ĵ��Ӳ�ṹ����Y��ClԪ�أ�
��1������������������ 2 ����Ԫ�أ���Ϊ�ڶ����ڵ�Ԫ�أ���������4����ΪC����Ϊ�������ڵ�Ԫ�أ���������6����ΪS��
��2���������������ڲ��������һ�룬���ʿ���Ϊ�缫���ϵ�Ԫ�أ���Ԫ��Ϊ�������������Ԫ�أ������ڱ��е�λ���ǵ�������IA �壻
��3��ԭ�Ӱ뾶���Ķ�����Ԫ����Na���ؿ��к�������Ԫ����O���γ�ԭ�Ӹ�����Ϊ 1:1 �Ļ�������Na2O2���������ӷ���ΪO22-��
��4���������������۴�����Ϊ��Ķ�����Ԫ������A���C��Si �������������ֱ���CO2��SiO2��������Ԫ�������ȶ�����̬�⻯����HF������HF��Ӧ����SiO2����Ӧ����ʽ��SiO2+ 4HF = SiF4��+2H2O��
��5����������Ԫ���У������Ӱ뾶��С��Ԫ����Al��Al3+�ṹʾ��ͼΪ![]() ��
��
��6��Y��ClԪ�أ�Cl������������Ӧˮ������HClO4������Ϊ�����


 ��ʱѵ���������������ϵ�д�
��ʱѵ���������������ϵ�д� �ƸԾ���Ȥζ����ϵ�д�
�ƸԾ���Ȥζ����ϵ�д� ����С����ҵ��ϵ�д�
����С����ҵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������ЧӦ����Դ��ȱ����������ӣ���ν��ʹ�����CO2�ĺ�������Ч�ؿ�������CO2�������˸������ձ����ӡ�
��Ŀǰ��ҵ����һ�ַ�������CO2������ȼ�ϼ״���Ϊ̽����Ӧԭ�����ֽ�������ʵ�飬�����Ϊ1 L���ܱ������У�����1mol CO2��3mol H2��һ�������·�����Ӧ��CO2(g)��3H2(g)![]() CH3OH(g)��H2O(g) ��H����49.0kJ/mol�����CO2��CH3OH(g)��Ũ����ʱ��仯��ͼ��ʾ��
CH3OH(g)��H2O(g) ��H����49.0kJ/mol�����CO2��CH3OH(g)��Ũ����ʱ��仯��ͼ��ʾ��

�ٴӷ�Ӧ��ʼ��ƽ�⣬������ƽ����Ӧ����v(H2)��_____mol/(L��min)��
�ڸ÷�Ӧ��ƽ�ⳣ������ʽΪK=_________��
�����д�ʩ����ʹn(CH3OH)��n(CO2)�������___________��
A�������¶� B������He(g)��ʹ��ϵѹǿ����
C����H2O(g)����ϵ�з��� D���ٳ���1mol CO2��3mol H2
�����������������Ʒ�Ӧ2CO(g)��2C(s)��O2(g) ͨ�����Է�����������CO����Ⱦ���÷���_______(����������������)���У������ǣ�_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���װ�![]() �������백���ƣ�
�������백���ƣ�![]() Ҳ��һԪ���
Ҳ��һԪ���![]() ʱ���볣��
ʱ���볣��![]() ������
������![]() ��ϡ����ζ�
��ϡ����ζ�![]() �ļװ���Һ����Һ��
�ļװ���Һ����Һ��![]() �ĸ�����pOH������ϡ��������
�ĸ�����pOH������ϡ��������![]() �Ĺ�ϵ��ͼ��ʾ������˵����ȷ����( )
�Ĺ�ϵ��ͼ��ʾ������˵����ȷ����( )
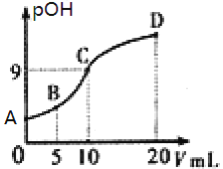
A.B����Һ�д���![]()
B.�װ���ˮ�еĵ��뷽��ʽΪ��![]()
C.A��B��C������Һ�У���ˮ���������![]() ��
��![]()
D.C��������Һ��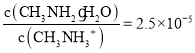
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��80��ʱ��1L �ܱ������г���0.20 mol N2O4��������ӦN2O4![]() 2NO2 ��H = + Q kJ��mol��1(Q��0)������������ݣ�
2NO2 ��H = + Q kJ��mol��1(Q��0)������������ݣ�
ʱ��/s | 0 | 20 | 40 | 60 | 80 | 100 |
c(NO2)/mol��L��1 | 0.00 | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
�����ж���ȷ����
A. �����¶ȸ÷�Ӧ��ƽ�ⳣ��K��С
B. 20��40s �ڣ�v(N2O4)= 0.004 mol��L��1��s��1
C. 100sʱ��ͨ��0.40 mol N2O4������ƽ��ʱN2O4��ת��������
D. ��Ӧ��ƽ��ʱ�����յ�����Ϊ0.15Q kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ø߷���������֬��ȡ±ˮ�еĵ⣨��Ҫ�� I-��ʽ���ڣ��Ĺ����������£�˵������ȷ����
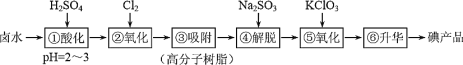
A.���̢ڵķ�Ӧ˵�� I �ķǽ��������� Cl
B.���ٺ͢�������Һ�У�I-��Ũ�Ⱥ��ߴ���ǰ��
C.��Ԫ�ص����ԭ�������� 35.5, ����ڵ� 35Cl ��37Cl �ķ�ȱ�ԼΪ 3:1
D.�������̢ں͢���Ҫ�õ������� I2���������ĵ� n(Cl2) :n(KClO3) = 5:2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ե������Ǵӷ仨��ֲ������ȡ�õ����������ʣ���ṹ��ʽ��ͼ��ʾ������������ȷ����(����)
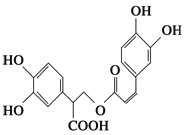
A. �Ե��������嵥��ֻ�ܷ���ȡ����Ӧ
B. 1 mol�Ե���������ܺ�9 mol���������ӳɷ�Ӧ
C. �Ե�������Է���ˮ�ⷴӦ��ȡ����Ӧ��������Ӧ
D. 1 mol�Ե���������ܺ�5 mol NaOH������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼʾ���Ӧ�����������
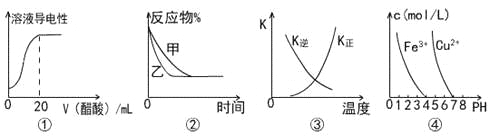
A.ͼ�ٱ�ʾ��20 mL 0.1 mol/L��ˮ����μ���0.1 mol/L���ᣬ��Һ�����������������ı仯
B.ͼ�ڱ�ʾѹǿ�Կ��淴ӦA(g)+2B(g)![]() 3C(g)+D(s)��Ӱ�죬�ҵ�ѹǿ�ȼ�ѹǿ��
3C(g)+D(s)��Ӱ�죬�ҵ�ѹǿ�ȼ�ѹǿ��
C.ͼ�������߱�ʾ��Ӧ3A(g) + B(g)![]() 2C��g����H��0�������淴Ӧ��ƽ�ⳣ��K���¶ȵı仯
2C��g����H��0�������淴Ӧ��ƽ�ⳣ��K���¶ȵı仯
D.��ͼ�ܣ���Ҫ��ȥCuSO4��Һ�е�Fe3+���ɼ���NaOH��Һ��pH��4����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����![]() ��һ����������
��һ����������![]() ��Ӧת��Ϊ�״�
��Ӧת��Ϊ�״�![]() �DZ��Ϊ���ĺ÷�����һ�������£�ÿת��
�DZ��Ϊ���ĺ÷�����һ�������£�ÿת��![]() �ų�������Ϊ
�ų�������Ϊ![]() ��
��![]() ת��Ϊ�״�������Ũ����ʱ��ı仯������ͼ��ʾ
ת��Ϊ�״�������Ũ����ʱ��ı仯������ͼ��ʾ![]() ��֪��Ӧ����������ڴ������¾�Ϊ����
��֪��Ӧ����������ڴ������¾�Ϊ����![]() ��������������ȷ����
��������������ȷ����
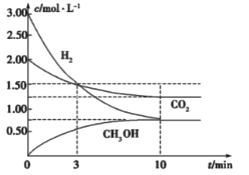
A.�ڽ��е�3����ʱ��![]() ��
��![]() ������ķ�Ӧ����ֵ��ȣ���Ϊ
������ķ�Ӧ����ֵ��ȣ���Ϊ![]()
B.�˷�Ӧ���Ȼ�ѧ����ʽΪ��![]()
C.�������·�Ӧ��ƽ�ⳣ��Ϊ![]()
D.�����¶ȣ��˷�Ӧ��ƽ�ⳣ������Ϊ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ھ����˵����ȷ������ǣ� ��
�ٷ��Ӿ����ж����ڹ��ۼ�
���ھ�����ֻҪ�������Ӿ�һ����������
�۽��ʯ��SiC��H2O��H2S������۵����ν���
�����ӻ�������ֻ�����Ӽ�û�й��ۼ������Ӿ����п϶�û�����Ӽ�
��CaTiO3������(�����ṹ��ͼ��ʾ)ÿ��Ti4����12��O2�������
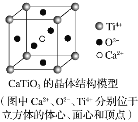
��SiO2������ÿ����ԭ����������ԭ���Թ��ۼ�����
�߾����з��Ӽ�������Խ����Խ�ȶ�
���Ȼ�������ˮʱ���Ӽ����ƻ�
A. �٢ڢۢ�B. �٢ڢ�C. �ۢݢ�D. �ۢݢ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com