
| 元素代号 | A | B | C | D | E | N | G |
| 原子半径/nm | 0.182 | 0.160 | 0.089 | 0.143 | 0.102 | 0.099 | 0.071 |
| 主要化合价 | +1 | +2 | +2 | +3 | +6、-2 | -1 | -1 |
| A. | 稳定性:HG>HN;熔沸点:HG>HN | |
| B. | 工业上常用电解熔融DN3的方法冶炼D单质 | |
| C. | B、C原子的价电子数相同 | |
| D. | 0.1mol/L的最高价氧化物的水化物溶液的pH:A≠N |
分析 各元素均为短周期元素,E的化合价为+6、-2,则E为S元素;A的原子半径大于S,化合价为+1,则A为Na元素;N、G的主要化合价都为-1,说明二者位于ⅤⅡA族,根据原子半径可知,N为Cl、G为F元素;D的化合价为+3,原子半径大于Cl元素,则D为Al元素;B、C的化合价都为+2,根据原子半径B>C可知,B为Mg元素,C为Be元素,据此结合元素周期律知识解答.
解答 解:各元素均为短周期元素,E的化合价为+6、-2,则E为S元素;A的原子半径大于S,化合价为+1,则A为Na元素;N、G的主要化合价都为-1,说明二者位于ⅤⅡA族,根据原子半径可知,N为Cl、G为F元素;D的化合价为+3,原子半径大于Cl元素,则D为Al元素;B、C的化合价都为+2,根据原子半径B>C可知,B为Mg元素,C为Be元素,
A.非金属性越强,对应气态氢化物的稳定性越强,则非金属性:F>Cl,则气态氢化物的稳定性:HF>HCl;由于HF能形成分子间氢键,使沸点反常的升高,熔沸点HF>HCl,故A正确;
B.氯化铝为共价化合物,工业上用电解熔融的氧化铝的方法制备金属铝,故B错误;
C.B为Mg元素,C为Be元素,最外层电子数相同,故价电子数相等,故C正确;
D.A的最高价氧化物的水化物为氢氧化钠,N为高氯酸,相同浓度时两者的pH不等,故D正确;
故选B.
点评 本题考查了原子结构与元素周期律的应用,根据表中信息正确推断元素为解答关键,注意掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的分析能力及灵活应用能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
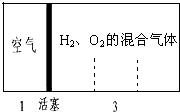 如图所示装置,室温下密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央,则原来H2、O2的体积比最接近于( )
如图所示装置,室温下密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央,则原来H2、O2的体积比最接近于( )| A. | ①② | B. | ③④ | C. | ②④ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+、Al3+、Cl-、NO${\;}_{3}^{-}$ | B. | K+、Na+、I-、SO${\;}_{4}^{2-}$ | ||
| C. | Ag+、Ca2+、NH${\;}_{4}^{+}$、NO${\;}_{3}^{-}$ | D. | Na+、Ba2+、CO${\;}_{3}^{2-}$、SO${\;}_{4}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol化合物 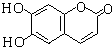 分别与足量的浓溴水、足量的NaOH溶液反应,消耗Br2和NaOH的物质的量相等 分别与足量的浓溴水、足量的NaOH溶液反应,消耗Br2和NaOH的物质的量相等 | |
| B. | 等质量的乙醇、乙烯、甲烷分别充分燃烧,所耗用氧气的量依次减少 | |
| C. | 聚乳酸(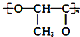 )是由单体之间通过加聚反应合成的 )是由单体之间通过加聚反应合成的 | |
| D. | 实验证实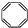 可使溴的四氯化碳溶液褪色,说明该分子中存在碳碳双键 可使溴的四氯化碳溶液褪色,说明该分子中存在碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该分散系的分散质为Fe2O3 | |
| B. | 在电场作用下,阴极附近分散系黑色变深,则说明该分散系带正电荷 | |
| C. | 加入NaOH时发生的反应可能为:Fe2++2Fe3++8OH-═Fe3O4+4H2O | |
| D. | 可用过滤的方法将黑色金属氧化物与Na+分离开 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| M(OH)n | KSP | pH | |
| 开始沉淀 | 沉淀完全 | ||
| Al(OH)3 | 2.0×10-52 | 3.8 | - |
| Fe(OH)3 | 4.0×10-38 | 1.9 | 3.2 |
| Fe(OH)2 | 8.0×10-16 | 6.95 | 9.95 |
| Ni(OH)2 | 6.5×10-38 | 5.9 | 8.9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com