
科目:高中化学 来源:不详 题型:单选题
| A.m<n | B.m>n | C.m=n | D.无法确定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 质的量浓度相同时
质的量浓度相同时 ,三种溶液中水的电离程度由大到小的顺序是____________.(用a、b、c表示,下同)
,三种溶液中水的电离程度由大到小的顺序是____________.(用a、b、c表示,下同) aOH的能力由大到小的顺序是___________.
aOH的能力由大到小的顺序是___________. __________.
__________. ,c(H+)由大到小的顺序是_________________.
,c(H+)由大到小的顺序是_________________.查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1 L 0.3 mol/L CH3COOH溶液和3 L 0.1 mol/L CH3COOH溶液中的H+数 |
| B.pH=1的CH3COOH溶液和盐酸的物质的量浓度 |
| C.pH=12的氨水和NaOH溶液的导电能力 |
| D.pH相同的等体积的盐酸和醋酸溶液分别与足量锌粒反应产生的气体体积 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 K2HPO4溶液中水解
K2HPO4溶液中水解 程度大于电离程度,对于平衡HPO42-+H2O
程度大于电离程度,对于平衡HPO42-+H2O 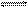 H
H 3O++PO43-,欲使溶液中c(HPO42-)、c(PO43-)、c(H3O+)三种离子浓度均减少,可采用的方法是( )
3O++PO43-,欲使溶液中c(HPO42-)、c(PO43-)、c(H3O+)三种离子浓度均减少,可采用的方法是( )| A.加水 | B.加热 | C.加消石灰 | D.加AgNO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.某电解质溶于水后,其导电能力不强,则此电解质必定是弱电解质 |
B.SO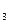 溶于水后,所得溶液导电性很好,故SO 溶于水后,所得溶液导电性很好,故SO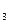 是强电解质 是强电解质 |
| C.共价化合物都是弱电解质 |
| D.弱电解质溶液中,同时存在着电解质电离出来的离子及未电离的分子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 常数为K1、K2,其大小依次是K1>KHA>K2,由此可以推测以下各反应中不
常数为K1、K2,其大小依次是K1>KHA>K2,由此可以推测以下各反应中不 NaHB+HA B.2NaA+H2B
NaHB+HA B.2NaA+H2B Na2B+2HA
Na2B+2HA NaA+H2B D.Na2B+HA
NaA+H2B D.Na2B+HA NaHB+NaA
NaHB+NaA查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com