
【题目】下列电离方程式中,正确的是( )
A. H2SO4=H2++SO42-B. Ba(OH)2=Ba2++OH﹣
C. NaNO3=Na++NO3-D. CuSO4=Cu2++SO42-
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】将153.5g由氯化钠和氯化镁混合而成的盐溶解于水配成1L溶液,测得溶液中Cl—的浓度为3mol/L,则溶液中Na+的物质的量浓度为
A. 2mol/L B. 1 mol/L C. 0.5 mol/L D. 0.1 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某溶液中c(Na+)=0.4mol/L,c(Mg2+)=0.25mol/L,c(Cl—)=0.4mol/L,如果溶液中还有SO42—,那么c(SO42—)应为
A. 0.25 mol /LB. 0.15 mol /LC. 0.1 mol /LD. 0.3mol /L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,△H能正确表示物质的燃烧热的是( )
A.CO(g)+ ![]() O2(g)═CO2(g);△H=﹣283.0 kJ/mol
O2(g)═CO2(g);△H=﹣283.0 kJ/mol
B.C(s)+ ![]() O2(g)═CO(g);△H=﹣110.5 kJ/mol
O2(g)═CO(g);△H=﹣110.5 kJ/mol
C.H2(g)+ ![]() O2(g)═H2O(g);△H=﹣241.8 kJ/mol
O2(g)═H2O(g);△H=﹣241.8 kJ/mol
D.2C8H18(l)+25O2(g)═16CO2(g)+18H2O(l);△H=﹣11036 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列叙述,写出元素名称并画出原子结构示意图:
信息 | 元素名称 | 原子结构示意图 |
A元素原子核外M层电子数是L层电子数的一半 | ____ | ____ |
B元素原子最外层电子数是次外层电子数的1.5倍 | ____ | ____ |
C元素+1价离子C+的电子层排布与Ne相同 | ____ | ____ |
D元素原子次外层电子数是最外层电子数的 | ____ | ____ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下图所示元素周期表中全部是金属元素的区域为___________
A.A B.B C.C D.D
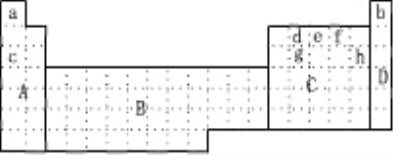
(2)现有甲、乙两种短周期元素,室温下,甲元素单质在冷浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等。
①用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置。______________
②甲、乙两元素相比较,金属性较强的是_________(填名称),可以验证该结论的实验是_______。
A.将在空气中放置很久的这两种元素的块状单质分别放入热水中
B.将这两元素的单质粉末分别和同浓度的盐酸反应
C.将这两元素的单质粉末分别和热水作用,并滴入酚酞
D.比较这两种元素的气态氢化物的稳定性
(3)上表中所列某些元素间能形成等电子的A、B、C、D、E五种微粒,A与C组成元素相同,B、E、D组成元素相同,它们间能发生如下反应:A+B=C+D,E+B=2D,则写出B的电子式:______,比较C、B、D结合氢离子的能力由强到弱的顺序为_________________(用化学式表示)。
(4)上表中c、h元素形成的简单离子半径之比________ 1(填〉或〈或 =)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在工农业生产和生命活动中起着重要的作用,铵盐、硝酸盐均是植物生长的“食物”,将氮气转化为氮气是植物获得“食物”的第一步,在常温常压下使N2高效地转化成为NH3是众多科学家们一直在探究的问题:
(1)已知:①4NH3(g)+5O2(g)4NO(g)+6H2O(g)△H=﹣1025kJmol﹣1②N2(g)+O2(g)2NO(g)△H=+180.5kJmol﹣1
水的汽化热△H=+44kJmol﹣1
据报道,科学家已找到一种催化剂,使氨气与液态水在常温条件下转化为NH3及氧气,写出反应的热化学方程式;
(2)工业时合成氨的原理为:N2(g)+3H2(g)2NH3(g)△H=﹣92.4kJmol﹣1 . 图1表示H2的转化率与温度、压强之间的关系,图2表示H2的转化率与起始投料比[n(N2)/n(H2)]、压强的变化关系,则T1、T2、T3的大小关系为 , 曲线与曲线对应的压强P1P2(填“>”“<”“=”).测得B(X,60)点时N2的转化率为40%,则X=
(3)一定温度下,将2molN2和6molH2置于一密闭容器中反应,测得平衡时容器的总压为aMPa,NH3的物质的量总数为20%,列式计算出此时的平衡常数Kp=(用平衡分压代替平衡浓度进行计算,分压=总压×体积分数,可不化简).下列各项中能说明反应已达到平衡状态的是 . a.混合气体的平均相对分子质量不变 b.N2的消耗速率等于NH3的生成速率
c.混合气体的密度不变 d.N2和H2的物质的量之比保持不变
(4)NH3催化剂生成NO,以NO为原料通过电解的方法可以制备NH4NO3 , 其总反应是8NO+7H2═3NH4NO3+2HNO3 , 试写出以惰性材料作电极的阴极反应式: . 电解过程中为使电解产物全部转化为NH4NO3 , 需要补充NH3的原因是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com