
分析 硫酸的第一步电离是完全的:H2SO4=H++HSO4-,第二步电离并不完全:HSO4-?H++SO42-.
(1)Na2SO4溶液存在SO42-+H2O?OH-+HSO4-,溶液呈弱碱性;
(2)根据硫酸溶液中存在HSO4-离子书写离子方程式;
(3)在0.10mol•L-1的Na2SO4溶液中离子浓度关系:
A、溶液中硫酸完全电离分析;
B、依据溶液中存在质子守恒为;
C、依据溶液中存在电荷守恒分析;
D、依据物料守恒分析判断;
(4)依据硫酸在水中的第一步电离是完全的,第二步电离并不完全,结合平衡移动分析判断;
(5)依据氢离子浓度对硫酸氢根离子的电离平衡影响分析判断.
解答 解:根据硫酸的第一步电离是完全的:H2SO4=H++HSO4-,第二步电离并不完全:HSO4-?H++SO42-,则
(1)Na2SO4溶液存在SO42-+H2O?OH-+HSO4-,溶液呈弱碱性,故答案为:弱碱性;SO42-+H2O?OH-+HSO4-;
(2)硫酸溶液中存在HSO4-离子,难电离,硫酸与氯化钡溶液反应的离子方程式为:HSO4-+Ba2+=BaSO4↓+H+,故答案为:HSO4-+Ba2+=BaSO4↓+H+;
(3)在0.10mol•L-1的Na2SO4溶液中离子浓度关系:
A、溶液中硫酸完全电离,故A错误;
B、溶液中存在质子守恒为:c(OH-)=c( HSO4-)+c(H+),故B正确;
C、溶液中存在电荷守恒:c( Na+)+c(H+)=c(OH-)+c(HSO4-)+2c(SO42-),故C正确;
D、依据物料守恒,c( Na+)=2c(SO42-)+2c(HSO4-),故D正确;
故选BCD;
故答案为:BCD;
(4)25℃时,0.10mol•L-1的NaHSO4溶液中c( SO42-)=0.029mol•L-1,H2SO4═HSO4-+H+,则0.10mol•L-1的H2SO4溶液中氢离子浓度比硫酸氢钠溶液中大,对硫酸氢根离子电离平衡起到抑制作用,c( SO42-)<0.029mol•L-1,
故答案为:<;硫酸溶液中氢离子浓度大,对硫酸氢根离子电离平衡起到抑制作用;
(5)若25℃时,0.10mol•L-1H2SO4溶液的pH=-lgO.11,C(H+)=0.11mol/L;依据:①H2SO4=H++HSO4-,②HSO4-?H++S042-.①电离出的氢离子浓度为0.10mol/L;所以②电离出的氢离子浓度为0.11mol/L-0.1.mol/L=0.01mol/L;则0.10mol•L-1的H2SO4溶液中c(SO42-)=0.01mol/L,
故答案为:0.01mol/L.
点评 本题考查电解质的电离和离子方程式的书写,溶液中电荷守恒应用,物料守恒的应用,题目难度中等,本题注意把握题意,突破硫酸为二元强酸的思维,从题目实际出发,加强自学能力的培养.


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:解答题
 某同学用如图所示装置制取次氯酸钠.图中瓶乙盛饱和食盐水,瓶丙盛浓硫酸,分液漏斗A中盛浓盐酸.试完成下列问题:
某同学用如图所示装置制取次氯酸钠.图中瓶乙盛饱和食盐水,瓶丙盛浓硫酸,分液漏斗A中盛浓盐酸.试完成下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,分子中氮原子轨道的杂化类型是sp3.
,分子中氮原子轨道的杂化类型是sp3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑤⑥ | B. | ④⑥⑦ | C. | ③④⑦ | D. | 以上都不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
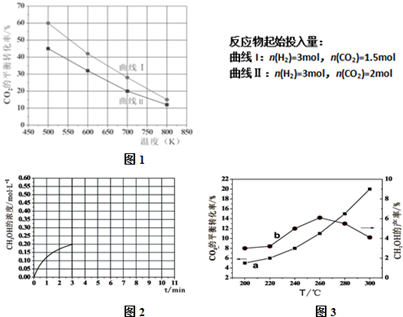
 在一个体积为2L的真空密闭容器中加入0.5molCaCO3,发生反应CaCO3(s)=CaO (s)+CO2(g),测得二氧化碳的物质的量浓度随温度的变化关系如图表示,图中A表示CO2的平衡浓度与温度的关系曲线,B表示不同温度下反应经过相同时间时CO2的物质的量浓度的变化曲线.请按要求回答下列问题:
在一个体积为2L的真空密闭容器中加入0.5molCaCO3,发生反应CaCO3(s)=CaO (s)+CO2(g),测得二氧化碳的物质的量浓度随温度的变化关系如图表示,图中A表示CO2的平衡浓度与温度的关系曲线,B表示不同温度下反应经过相同时间时CO2的物质的量浓度的变化曲线.请按要求回答下列问题:| 物质 | 电离平衡常数(25℃) |
| C6H5OH | Ki=1.28×10-10 |
| H2CO3 | Ki1=4.3×10-7 |
| Ki2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
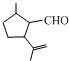 的分子式为C10H16O;其含有的含氧官能团名称是醛基.
的分子式为C10H16O;其含有的含氧官能团名称是醛基.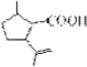 .
. .生成B物质的反应类型为:取代反应.
.生成B物质的反应类型为:取代反应.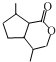 的同分异构体
的同分异构体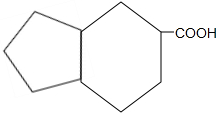 .(任写一种)
.(任写一种)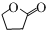 的合成路线图(无机试剂任选),合成路线流程图如下:
的合成路线图(无机试剂任选),合成路线流程图如下: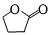
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线:
苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线: +HO2+H2SO4$\stackrel{100-130℃}{→}$
+HO2+H2SO4$\stackrel{100-130℃}{→}$ +NH4HSO4
+NH4HSO4 +Cu(OH)2→(
+Cu(OH)2→( )2Cu+H2O
)2Cu+H2O )到硫酸溶液中,然后升温至130℃继续反应,仪器c的名称是球形冷凝管.反应结束后加适量冷水,再分离出苯乙酸(
)到硫酸溶液中,然后升温至130℃继续反应,仪器c的名称是球形冷凝管.反应结束后加适量冷水,再分离出苯乙酸( )粗品.加入冷水的目的是便于苯乙酸析出.
)粗品.加入冷水的目的是便于苯乙酸析出.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com