
【题目】下列离子方程式中书写正确的有几项
① FeS固体与稀硝酸混合:FeS + 2H+ = Fe2++H2S
② 用过量氨水吸收烟道气中的SO2:SO2+2NH3·H2O =SO32-+2NH4++H2O
③ 将少量SO2气体通入NaClO溶液中:SO2+2ClO-+H2O=SO32-+2HClO
④ 已知Ka1(H2CO3)> Ka(HClO)> Ka2(HCO3-),向NaClO溶液中通入少量CO2:2ClO-+CO2+H2O=2HClO+CO32-
⑤ 铁屑溶于足量稀硝酸:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O
⑥ 氯气溶于水:Cl2+H2O=2H++Cl-+ClO-
⑦ 实验室用NH4Cl和Ca(OH)2制氨气:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
⑧ 向NH4Al(SO4)2溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O
⑨ 实验室制Cl2:4HCl(浓)十MnO2![]() Mn2++2Cl-+Cl2↑+2H2O
Mn2++2Cl-+Cl2↑+2H2O
⑩ FeCl3溶液刻蚀铜制电路板:Fe3+ +Cu = Fe2+ + Cu2+
A. 1 项 B. 2 项 C. 3 项 D. 4 项
【答案】A
【解析】①FeS固体与稀硝酸混合,硫离子和亚铁离子都被硝酸氧化,正确的离子方程式为:FeS+NO3-+4H+=Fe3++S↓+NO↑+2H2O,故①错误;②过量的氨水吸收烟道气中的SO2,离子方程式:SO2+2NH3H2O═2NH4++SO32-+H2O,故②正确;③少量SO2气体通入NaClO溶液中,二氧化硫被氧化成硫酸根离子,正确的离子方程式为:ClO-+H2O+SO2═SO42-+2H++Cl-,故③错误;④酸性H2CO3>HClO>HCO3-,向NaClO溶液中通入少量二氧化碳生成HCO3-,ClO-+CO2+H2O═HClO+HCO3-,故④错误;⑤铁屑溶于足量稀硝酸的离子反应为Fe+4H++NO3-═Fe3++NO↑+2H2O,故⑤错误;⑥氯气溶于水生成的HClO是弱酸,其离子反应方程式为Cl2+H2O=H++Cl-+HClO,故⑥错误;⑦实验室用NH4Cl和Ca(OH)2制氨气没有发生离子反应,不能书写离子方程式,故⑦错误;⑧向NH4Al(SO4)2溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全时发生的离子反应为NH4++Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+Al(HO)3↓+NH3·H2O,故⑧错误;
⑨利用MnO2和浓盐酸混合加热制Cl2时发生的离子反应为4H++2Cl-十MnO2![]() Mn2++Cl2↑+2H2O,故⑨错误;⑩FeCl3溶液刻蚀铜制电路板时发生的离子反应为2Fe3+ +Cu = 2Fe2+ + Cu2+,故⑩错误;只有②正确,故答案为A。
Mn2++Cl2↑+2H2O,故⑨错误;⑩FeCl3溶液刻蚀铜制电路板时发生的离子反应为2Fe3+ +Cu = 2Fe2+ + Cu2+,故⑩错误;只有②正确,故答案为A。


科目:高中化学 来源: 题型:
【题目】下列有关生物大分子的叙述,正确的是
A. 组成生物大分子的单体都是以碳链为基本骨架
B. 糖类、蛋白质和核酸都是生物大分子
C. 构成生物大分子核酸的单体是核糖、磷酸和碱基
D. 生物大分子的主要功能是为细胞提供能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中A~H均为中学化学中常见的物质,A、B、H是气体,它们之间有如图转化关系(反应中生成的水已略去). 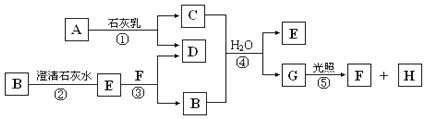
请回答以下问题:
(1)E是(填化学式),G是(填名称);
(2)C物质在日常生活中可作;
(3)写出反应①的化学方程式; C与浓盐酸反应,可以生成A气体,写出反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某温度下,纯水的c(H+)=2×10- 7 mol·L-1,则此时c(OH-)为______;若温度不变,滴入稀盐酸使c(H+)=5×10- 4 mol·L-1则溶液中由水电离产生的c(H+)为______,此时温度______(填“高于”、“低于”或“等于”)25℃。
(2)已知C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
①C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ/mol
②H2(g)+![]() O2(g)===H2O(g) ΔH2=-242.0 kJ/mol
O2(g)===H2O(g) ΔH2=-242.0 kJ/mol
③CO(g)+![]() O2(g)===CO2(g) ΔH3=-283. 0 kJ/mol
O2(g)===CO2(g) ΔH3=-283. 0 kJ/mol
写出C(s)与水蒸气反应生成CO和H2的热化学方程式:
_________________________________________________。
(3)常温下,取物质的量浓度相同的NaOH和HCl溶液,以3∶2体积比相混合,所得混合液的pH=12,则原溶液的物质的量浓度为______。(溶液体积变化忽略不计)
(4)常温下,0.l mol·L-1 H3PO4溶液的pH小于7,括号内离子浓度的大小顺序为(H2PO4- 、HPO42- 、PO43- 、OH- 和H +)___________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从50mL 5mol·L-1的盐酸中取出5mL,这5mL溶液的物质的量浓度是 ( )
A. 5mol/L B. 0.5 mol/L C. 50mol/L D. 1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证卤素单质氧化性的相对强弱,某小组用如图所示装置进行实验(夹持仪器已略去,气密性已检验). 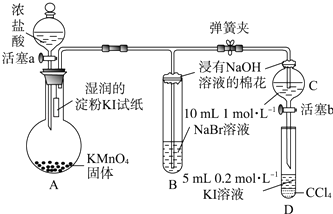
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸.
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹.
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a.
Ⅳ.…
(1)A中产生黄绿色气体,其电子式是 .
(2)验证氯气的氧化性强于碘的实验现象是 .
(3)B中溶液发生反应的离子方程式是 .
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是 .
(5)过程Ⅲ实验的目的是 .
(6)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下 , 得电子能力逐渐减弱.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质与用途具有对应关系的是( )
A.NaClO能使蛋白质变性,可用于配制消杀剂
B.Na2CO3易溶于水,可用于去除餐具表面油污
C.FeCl3水解显酸性,可用于催化H2O2的分解
D.醋酸具有挥发性,可用于溶洗热水器内水垢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,有关零排放车载燃料电池叙述正确的是( ) 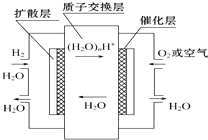
A.正极通入H2 , 发生还原反应
B.负极通入H2 , 发生还原反应
C.总反应式为2H2+O2=2H2O
D.导电离子为质子,且在电池内部由正极定向移向负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固定和利用CO2能有效地利用资源,并减少空气中的温室气体.工业上有一种用CO2来生产甲醇燃料的方法:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=﹣49kJ/mol.某科学实验在一定温度下,将6molCO2和8molH2充入2 L的密闭容器中,测得H2的物质的量随时间变化如图实线所示.a,b,c,d括号内数据表示坐标. 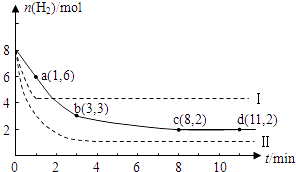
(1)0~a,a~b,b~c,c~d四段中,平均反应速率最大的时间段是 , 该时间段内H2的平均反应速率是 .
(2)a点正反应速率(填大于、等于或小于)逆反应速率.
(3)平衡时CO2的转化率是;反应前、后容器内的压强比是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com