
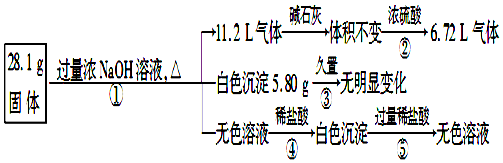
分析 根据生成气体通过碱石灰体积不变(无酸性气体),而通过浓硫酸体积减小,说明剩余的 6.72 L气体为氢气,即原固体中一定含有金属Al,且其物质的量为$\frac{6.72L}{22.4L/mol}$=0.3mol;生成氨气的物质的量为 $\frac{11.2L-6.72L}{22.4L/mol}$=0.2 mol,则原固体中一定含有 0.1 mol (NH4)2SO4,得到白色沉淀久置不变色,说明无FeCl2(氢氧化亚铁易被氧化为红棕色的氢氧化铁),因为NaOH过量,所以白色沉淀不可能含有氢氧化铝,则说明5.8 g白色沉淀为Mg(OH)2,其物质的量为0.1 mol,则固体中含有MgCl20.1 mol,质量为9.5g,据此进行解答.
解答 解:由流程图可知:第一步反应的离子方程式为:NH4++OH-═NH3↑+H2O、2Al+2OH-+2H2O═2AlO2-+3H2↑、Mg2++2OH-═Mg(OH)2↓、Al3++4OH-═AlO2-+2H2O,根据生成气体通过碱石灰体积不变(无酸性气体),而通过浓硫酸体积减小,说明剩余的 6.72 L气体为氢气,即原固体中一定含有金属Al,且其质量为$\frac{\frac{6.72L}{22.4L/mol}}{1.5}$×27 g/mol=5.4 g;生成氨气的物质的量为 $\frac{11.2L-6.72L}{22.4L/mol}$=0.2 mol,根据氮守恒则原固体中一定含有 0.1 mol (NH4)2SO4,质量为:0.1 mol×132g/mol=13.2g;得到白色沉淀久置不变色,说明无FeCl2(氢氧化亚铁易被氧化为红棕色的氢氧化铁),因为NaOH过量,所以白色沉淀不可能含有氢氧化铝,则说明5.8 g白色沉淀为Mg(OH)2,其物质的量为0.1 mol,则固体中含有MgCl20.1 mol,质量为9.5g,所以混合物的组成和各自的质量分别为Al 5.4g;(NH4)2SO413.2g; MgCl29.5g,
故答案为:Al 5.4g,(NH4)2SO413.2g,MgCl29.5g.
点评 本题考查无机物的推断,题目难度中等,侧重于元素化合物知识的综合应用,为高考常考查题型,注意根据相关数据进行判断,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:解答题
| 反应 | 大气固氮N2(g)+O2(g)?2NO(g) | 工业固氮N2(g)+3H2(g)?2NH3(g) | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.8×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
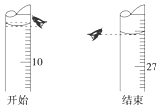 某同学欲用已知物质的量浓度为0.100 0mol•L-1的盐酸测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:
某同学欲用已知物质的量浓度为0.100 0mol•L-1的盐酸测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:| 滴定 | 待测溶液 体积/mL | 标准酸体积 | |
| 滴定前的刻度/mL | 滴定后的刻度/mL | ||
| 第一次 | 10.00 | V1 | V2 |
| 第二次 | 10.00 | 4.10 | 21.10 |
| 第三次 | 10.00 | 0.40 | 17.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,44g丙烷含有共价键的数目为9NA | |
| B. | 标准状况下,6.72 L NO2溶于足量的水中,转移电子的数目为0.3NA | |
| C. | 电解58.5g熔融的NaCl,能产生11.2L氯气、23.0g金属钠 | |
| D. | 1 L 1 mol.L-1的Na2CO3溶液中CO32-、HCO3-离子数目之和小于NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ③④ | C. | ②④⑤ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
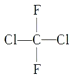 (商品名称为氟里昂-12,一种限制使用的制冷剂,类似于甲烷的结构)的叙述正确的是( )
(商品名称为氟里昂-12,一种限制使用的制冷剂,类似于甲烷的结构)的叙述正确的是( )| A. | 有两种同分异构体 | B. | 是烷烃 | ||
| C. | 只有一种结构 | D. | 有四种同分异构体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com