
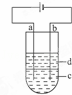
由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀.应用如下图所示电解实验可制得白色纯净的Fe(OH)2沉淀.两电极的材料分别为石墨和铁.
(1)a电极材料应为 ,电极反应式 ;
(2)电解液c可以是(填编号)
A.纯水 B.NaCl溶液 C.NaOH溶液 D.CuCl2溶液
(3)d为苯,其作用为 ,在加入苯之前对c应作怎样的简单处理? .
(4)为了在较短时间内看到白色沉淀,可采取的措施(填编号)
A.改用稀硫酸作电解液
B.适当增大电源的电压
C.适当减少两电极间距离
D.适当降低电解液的温度
(5)若c为Na2SO4溶液,当电解一段时间看到白色Fe(OH)2沉淀后,再反接电源电解,除了电极上看到气泡外,混合物中另一明显现象为 .
考点: 电解原理.
专题: 电化学专题.
分析: (1)制纯净的Fe(OH)2沉淀,则Fe为阳极,失去电子,a与电源正极相连,则a为阳极;
(2)纯水导电性太差,影响物质的制备,而NaCl、NaOH溶液中氢离子放电,可生成Fe(OH)2沉淀,电解液为CuCl2溶液,发生Fe+CuCl2=Cu+CuCl2;
(3)苯的密度水的小,不溶于水,可隔绝空气,防止氢氧化亚铁被氧化,并在实验之前对溶液煮沸,排出溶液中的氧气;
(4)短时间内看到白色沉淀,增大反应的速率即可;
(5)反接电源时,电解方程式是2H2O 2H2↑+O2↑,生成的O2会将Fe(OH)2氧化.
2H2↑+O2↑,生成的O2会将Fe(OH)2氧化.
解答: 解:(1)制纯净的Fe(OH)2沉淀,则Fe为阳极,失去电子,a与电源正极相连,则a为阳极,发生的电极反应为Fe﹣2e﹣=Fe2+,
故答案为:Fe;Fe﹣2e﹣=Fe2+;
(2)纯水导电性太差,影响物质的制备,而NaCl、NaOH溶液中氢离子放电,可生成Fe(OH)2沉淀,电解液为CuCl2溶液,发生Fe+CuCl2=Cu+CuCl2,
则电解液c可选择BC,故答案为:BC;
(3)苯的密度水的小,不溶于水,可隔绝空气,防止氢氧化亚铁被氧化,为防止氢氧化亚铁被氧化,并在实验加入苯之前,对c溶液进行加热煮沸的目的是排出溶液中的氧气,故答案为:隔绝空气防止氢氧化亚铁被氧化;加热煮沸;
(4)短时间内看到白色沉淀,适当增大电源电压、适当缩小两电极间距离可增大反应的速率,而改用稀硫酸不能生成沉淀,降低温度反应速率减慢,故答案为:BC.
(5)反接电源时,电解方程式是2H2O 2H2↑+O2↑,生成的O2会将Fe(OH)2氧化,其现象是白色沉淀迅速变为灰绿色,最终变为红褐色,故答案为:白色沉淀迅速变为灰绿色,最终变为红褐色.
2H2↑+O2↑,生成的O2会将Fe(OH)2氧化,其现象是白色沉淀迅速变为灰绿色,最终变为红褐色,故答案为:白色沉淀迅速变为灰绿色,最终变为红褐色.
点评: 本题考查氢氧化亚铁的制备和电解原理,明确电解原理及Fe为阳极是解答本题的关键,注意实验中防止氢氧化亚铁被氧化,题目难度不大.


科目:高中化学 来源: 题型:
下列说法正确的是()
①用丁达尔效应可以区分食盐水和淀粉溶液
②一种盐和另外一种盐反应一定生成两种新盐
③与Al反应且只产生H2的溶液中能大量存在:NH4+、Na+、Fe2+、NO3﹣
④由CaCO3的溶解度小于Ca(HCO3)2,可推出Na2CO3的溶解度小于NaHCO3
⑤向溶液中滴入盐酸,无现象,再加氯化钡溶液,可检验溶液中是否含有SO42﹣
⑥标准状况下,0.5NA个NO分子与0.5NA个O2分子混合后的体积约为22.4L.
A. ①③ B. ①④ C. ①⑤ D. ①⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中Cl﹣物质的量浓度最大的是()
A. 10mL0.1 mol•L﹣1的AlCl3溶液
B. 20mL0.1 mol•L﹣1的CaCl2溶液
C. 30mL0.2 mol•L﹣1的KCl溶液
D. 100mL0.25 mol•L﹣1的NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
利用如图装置探究铁在海水中的电化学腐蚀与防护.下列说法不正确的是()
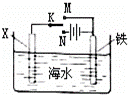
A. 若X为锌棒,开关K置于M处,可减缓铁的腐蚀,采用了牺牲阳极的阴极保护法
B. 若X为锌棒,开关K置于N处,X极的反应:4OH﹣﹣4e﹣=O2↑+2H2O
C. 若X为碳棒,开关K置于N处,可减缓铁的腐蚀,采用了外加电流的阴极保护法
D. 若X为碳棒,开关K置于M处,X极的反应:O2+4e﹣+2H2O=4OH﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是()
A. 在原电池的负极和电解池的阴极上都是发生失电子的氧化反应
B. 用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2
C. 用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 molNaOH
D. 电解精炼铜时,将粗铜作电解池的阴极,纯铜作电解池的阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A. 3.6g重水中含有的中子数为2NA
B. 16.0g的过氧(根)离子中含有的电子数为9NA
C. 100mL 3.0mol/L的盐酸与5.6g铁屑完全反应转移的电子数为0.3NA
D. 含2mol H2SO4的浓硫酸与足量金属铜完全反应,产生SO2分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
在相同条件下,分别将下列气体等体积混合于四支大小相同的试管中:①NO与NO2;②NO与O2;③NO2与O2;④SO2与NO2,将四支试管倒立于水中,各试管中水面上升高度应为( )
A. ①>②>③>④ B. ②>③>④>① C. ①=②=③=④ D. ③>②>①>④
查看答案和解析>>
科目:高中化学 来源: 题型:
把含硫酸铵和硝酸铵的混合液a L分成两等份.一份加入含b mol NaOH的溶液并加热,恰好把NH3全部赶出;另一份需消耗c mol BaCl2才能使SO42﹣完全沉淀,则原溶液中NO3﹣的物质的量浓度为( )
A. 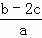 B.
B. 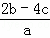 C.
C. 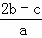 D.
D. 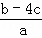
查看答案和解析>>
科目:高中化学 来源: 题型:
已知3375As、3579Br位于同一周期.下列关系正确的是()
A. 原子半径:As>Cl>P B. 热稳定性:HCl>AsH3>HBr
C. 还原性:As3﹣>S2﹣>Cl﹣ D. 酸性:H3AsO4>H2SO4>H3PO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com