
| A. | 氨气通入醋酸溶液中:CH3COOH+NH3═CH3COO-+NH4+ | |
| B. | 向苯酚纳溶液中通入少量的CO2:C6H5O-+CO2+H2O→C6H5OH+HCO3- | |
| C. | 等物质的量Cl2与FeBr2在溶液反应:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- | |
| D. | 惰性电极电解硫酸铜溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+ |
分析 A.氨气、醋酸写化学式,醋酸铵为强电解质,在离子方程式中醋酸铵应该拆开;
B.碳酸的酸性比苯酚的酸性强,碳酸氢根离子电离出氢离子的能力强于苯酚,苯酚钠通入二氧化碳生成苯酚和碳酸氢钠;
C.还原性Fe2+>Br-,氯气先氧化亚铁离子,亚铁离子反应完毕,再氧化溴离子,根据溴化亚铁和氯气的物质的量间的关系判断;
D.用惰性电解电解硫酸铜溶液时,阳极上氢氧根离子放电生成氧气,阴极上铜离子放电生成铜.
解答 解:A.氨气通入醋酸溶液中,反应生成强电解质醋酸铵,离子方程式为CH3COOH+NH3=CH3COO-+NH4+,故A正确;
B.碳酸的酸性比苯酚的酸性强,碳酸氢根离子电离出氢离子的能力强于苯酚,苯酚钠通入二氧化碳生成苯酚和碳酸氢钠,反应的化学方程式为C6H5ONa+CO2+H2O→C6H6OH+NaHCO3,离子反应为:C6H5O-+CO2+H2O→C6H5OH+HCO3-,故B正确;
C.向FeBr2中通入等物质的量Cl2,假设1mol Cl2,则FeBr21mol,则n(Fe2+)=n(FeBr2)=1mol,n(Br-)=2n(FeBr2)=2mol,亚铁离子优先反应,离子方程式:2Fe2++Cl2=2Fe3++2Cl-;消耗0.5mol Cl2,剩余0.5mol Cl2,然后部分溴离子被氯气氧化,2Br-+Cl2═Br2+2Cl-,氧化Br-的物质的量为1mol,所以n(Fe2+):n(Br-):n(Cl2)=1:1:1,所以总的反应的离子方程式为:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl-,故C错误;
D.用惰性电解电解硫酸铜溶液时,阳极上氢氧根离子放电生成氧气,阴极上铜离子放电生成铜,电池反应式为:2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4,离子反应为:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+,故D正确;
故选D.
点评 本题考查了离子方程式的正误判断,题目难度不大,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.


科目:高中化学 来源: 题型:解答题
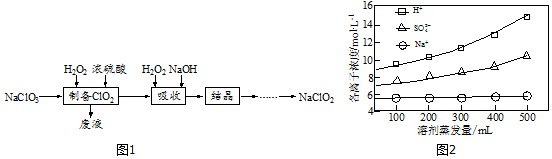
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
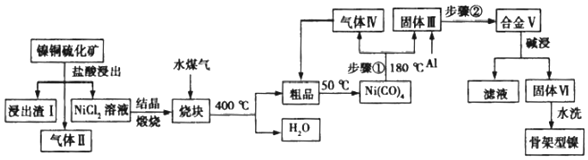
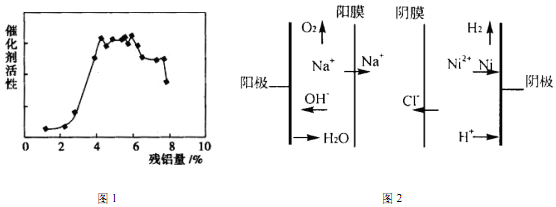
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30g C2H6中含有的共用电子对数为6NA | |
| B. | 1.0L 1.0mol•L-1Na3PO4水溶液中含有的氧原子数为4NA | |
| C. | 1 mol FeI2与足量氯气反应转移的电子数为3NA | |
| D. | 25℃时,1.0L pH=13的Ba(OH)2溶液中含有的OH-数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
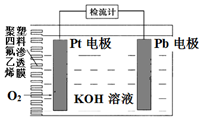 电池式氧传感器原理构造如图,可测定O2的含量.工作时铅极表面会逐渐附着Pb(OH)2.下列说法不正确的是( )
电池式氧传感器原理构造如图,可测定O2的含量.工作时铅极表面会逐渐附着Pb(OH)2.下列说法不正确的是( )| A. | Pt电极上发生还原反应 | |
| B. | 随着使用,电解液的pH逐渐减小 | |
| C. | a mmolO2反应,理论上可使Pb电极增重68a mg | |
| D. | Pb电极上的反应式为Pb+2OH--2e-=Pb(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用溴水一种试剂可将苯、四氯化碳、乙烯、乙醇、苯酚鉴别开 | |
| B. | 组成为C4H10O的醇与乙二酸在一定条件下生成二元酯的种类有10种 | |
| C. | 二糖、淀粉、纤维素水解的最终产物都是葡萄糖 | |
| D. | 芥子醇结构简式是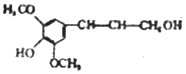 ,则分子中所有碳原子可能在同一平面且与足量溴水反应,最多消耗1molBr2 ,则分子中所有碳原子可能在同一平面且与足量溴水反应,最多消耗1molBr2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题



 ,该反应的反应类型为加成反应
,该反应的反应类型为加成反应 .
. .此空多余
.此空多余 可用于合成有机高分子色素,根据Claisen缩合反应,设计以甲醛和乙醛为原料合成聚丙烯醛的路线.合成路线流程图示例如下:H2C═CH2$→_{催化剂加热}^{HBr}$CH3CH2Br$→_{加热}^{NaOH溶液}$CH3CH2OH.HCHO+CH3CHO$→_{△}^{NaOH(aq)}$nCH2═CHCHO$→_{△}^{催化剂}$
可用于合成有机高分子色素,根据Claisen缩合反应,设计以甲醛和乙醛为原料合成聚丙烯醛的路线.合成路线流程图示例如下:H2C═CH2$→_{催化剂加热}^{HBr}$CH3CH2Br$→_{加热}^{NaOH溶液}$CH3CH2OH.HCHO+CH3CHO$→_{△}^{NaOH(aq)}$nCH2═CHCHO$→_{△}^{催化剂}$ .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A 原子最外层电子数比 B 原子的最外层电子数少 | |
| B. | A 原子电子层数比 B 原子的电子层数多 | |
| C. | 常温时,A能从酸中置换出氢,而B不能 | |
| D. | 1molA从酸中置换生成的 H2比 1mol B从酸中置换生成的 H2多 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com