
”¾ĢāÄæ”æĻĀ±ķ±ķŹ¾ŗĻ³É°±·“Ó¦£ØN2+3H2![]() 2NH3£©ŌŚ²»Ķ¬Ģõ¼žĻĀ“ļµ½Ę½ŗāŹ±»ģŗĻĪļÖŠ°±µÄŗ¬Įæ[ĘšŹ¼Ź±v£ØN2£©£ŗv£ØH2£©==1£ŗ3]”£
2NH3£©ŌŚ²»Ķ¬Ģõ¼žĻĀ“ļµ½Ę½ŗāŹ±»ģŗĻĪļÖŠ°±µÄŗ¬Įæ[ĘšŹ¼Ź±v£ØN2£©£ŗv£ØH2£©==1£ŗ3]”£
|
|
|
|
|
|
200 | 0.153 | 0.815 | 0.899 | 0.954 | 0.988 |
300 | 0.022 | 0.520 | 0.710 | 0.842 | 0.926 |
400 | 0.004 | 0.251 | 0.470 | 0.652 | 0.798 |
·ÖĪöÉĻ±ķŹż¾Ż£¬»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©200”ę”¢100MPaŹ±£¬Ę½ŗā»ģŗĻĪļÖŠ°±µÄŗ¬ĮæŅŃ“ļ0.988£¬Čē¹ū¼ĢŠųŌö“óŃ¹Ēæ______
£ØĢī”°ÄÜ”±»ņ”°²»ÄÜ”±£©Ź¹Ę½ŗā»ģŗĻĪļÖŠ°±µÄŗ¬ĮæµČÓŚ1£¬ĄķÓÉŹĒ£ŗ___________________________________________________________________________________________”£
£Ø2£©ÓūŹ¹Ę½ŗā»ģŗĻĪļÖŠ°±µÄŗ¬ĮæŌö“ó£¬ŌņæɲÉČ”µÄ“ėŹ©ÓŠ£ŗ____________________”£
£Ø3£©ÓūŹ¹Ę½ŗā»ģŗĻĪļÖŠ°±µÄŗ¬ĮæĪŖ0.710£¬ŌņŃ”ŌńµÄ·“Ó¦Ģõ¼žÓ¦ĪŖ£ŗ____________”£
”¾“š°ø”æ²»ÄÜ øĆ·“Ó¦ĪŖæÉÄę·“Ó¦£¬ŌŚŅ»¶ØĢõ¼žĻĀ½ųŠŠŹ±£¬½«“ļµ½»ÆŃ§Ę½ŗāדĢ¬£¬·“Ó¦Īļ²»æÉÄÜĶźČ«×Ŗ»ÆĪŖÉś³ÉĪļ Ōö“óŃ¹Ē棬½µµĶĪĀ¶Č ĪĀ¶ČĪŖ300”ę£¬Ń¹ĒæĪŖ30MPa
”¾½āĪö”æ
£Ø1£©ÓÉÓŚŹĒæÉÄę·“Ó¦£¬ĖłŅŌŌŚŅ»¶ØĢõ¼žĻĀ½ųŠŠŹ±£¬½«“ļµ½»ÆŃ§Ę½ŗāדĢ¬£¬·“Ó¦Īļ²»æÉÄÜĶźČ«×Ŗ»ÆĪŖÉś³ÉĪļ”£
£Ø2£©øł¾Ż±ķÖŠŹż¾ŻæÉÖŖ£¬½µµĶĪĀ¶Č»ņŌö“óŃ¹Ē棬æÉŹ¹Ę½ŗā»ģŗĻĪļÖŠ°±µÄŗ¬ĮæŌö“ó”£
£Ø3£©øł¾Ż±ķÖŠŹż¾ŻæÉÖŖ£¬ÓūŹ¹Ę½ŗā»ģŗĻĪļÖŠ°±µÄŗ¬ĮæĪŖ0.710£¬ŌņŃ”ŌńµÄ·“Ó¦Ģõ¼žÓ¦ĪŖĪĀ¶ČĪŖ300”ę£¬Ń¹ĒæĪŖ30Mpa”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻņijĆܱÕČŻĘ÷ÖŠ¼ÓČė 0.3 mol A”¢0.1 mol C ŗĶŅ»¶ØĮæµÄ B ČżÖÖĘųĢ壬 Ņ»¶ØĢõ¼žĻĀ·¢ÉśČēĻĀ·“Ó¦£ŗ 3A(g) ![]() B(g)£«2C(g)£¬ø÷ĪļÖŹµÄÅضČĖꏱ¼ä±ä»ÆČēĶ¼ĖłŹ¾[t0”«t1 ½×¶ĪµÄ c(B)±ä»ÆĪ“»³ö]”£ĻĀĮŠĖµ·ØÖŠÕżČ·µÄŹĒ( )
B(g)£«2C(g)£¬ø÷ĪļÖŹµÄÅضČĖꏱ¼ä±ä»ÆČēĶ¼ĖłŹ¾[t0”«t1 ½×¶ĪµÄ c(B)±ä»ÆĪ“»³ö]”£ĻĀĮŠĖµ·ØÖŠÕżČ·µÄŹĒ( )
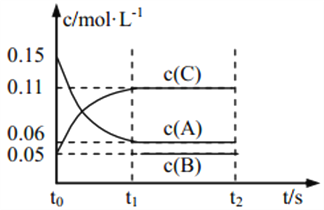
A. Čō t1£½15 s£¬ŌņÓĆ A µÄÅØ¶Č±ä»Æ±ķŹ¾ t0”«t1½×¶ĪµÄĘ½¾ł·“Ó¦ĖŁĀŹĪŖ 0.004 mol”¤L£1”¤s£1
B. t1Ź±øĆ·“Ó¦“ļµ½Ę½ŗā£¬ A µÄ×Ŗ»ÆĀŹĪŖ 60%
C. øĆČŻĘ÷µÄČŻ»żĪŖ2 L£¬BµÄĘšŹ¼µÄĪļÖŹµÄĮæĪŖ 0.02 mol
D. t0”«t1 ½×¶Ī£¬ “Ė¹ż³ĢÖŠČŻĘ÷ÓėĶā½ēµÄČČ½»»»×ÜĮæĪŖ a kJ£¬øĆ·“Ó¦µÄČČ»Æѧ·½³ĢŹ½ĪŖ 3A(g)![]() B(g)£«2C(g) ¦¤H£½£50a kJ”¤mol£1
B(g)£«2C(g) ¦¤H£½£50a kJ”¤mol£1
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŹµŃéŹŅŅŖÅäÖĘ1000 mL 2 mol/L NaOHČÜŅŗ£¬Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
(1)ĻĀĆęŹĒ¼øÖÖŹµŃéÖŠ³£ÓƵÄŅĒĘ÷£ŗ
A.  B.
B. ![]() C.
C. D.
D.![]()
¢ŁŠ“³öŅĒĘ÷AµÄĆū³Ę__________
¢ŚÅäÖĘ¹ż³ĢÖŠ²»ŠčŅŖŹ¹ÓƵĻÆѧŅĒĘ÷ÓŠ______(ĢīŅĒĘ÷µÄ×ÖÄø)”£
(2)ÓĆĶŠÅĢĢģĘ½³ĘČ”ĒāŃõ»ÆÄĘ£¬ĘäÖŹĮæĪŖ______g”£
(3)ĻĀĮŠÖ÷ŅŖ²Ł×÷²½ÖčµÄÕżČ·Ė³ŠņŹĒ_________(ĢīŠņŗÅ)”£
¢Ł³ĘČ”Ņ»¶ØÖŹĮæµÄĒāŃõ»ÆÄĘ£¬·ÅČėÉÕ±ÖŠ£¬ÓĆŹŹĮæÕōĮóĖ®Čܽā£»
¢Ś¼ÓĖ®ÖĮŅŗĆęĄėČŻĮæĘæ¾±æĢ¶ČĻßĻĀ1-2ĄåĆ׏±£¬øÄÓĆ½ŗĶ·µĪ¹ÜµĪ¼ÓÕōĮóĖ®ÖĮ°¼ŅŗĆęÓėæĢ¶ČĻßĻąĒŠ£»
¢Ū“żĄäČ“ÖĮŹŅĪĀŗ󣬽«ČÜŅŗ×ŖŅʵ½100 mL ČŻĮæĘæÖŠ£»
¢ÜøĒŗĆĘæČū£¬·“ø“ÉĻĻĀµßµ¹£¬Ņ”ŌČ£»
¢ŻÓĆÉŁĮæµÄÕōĮóĖ®Ļ“µÓÉÕ±ÄŚ±ŚŗĶ²£Į§°ō2~3“Ī£¬Ļ“µÓŅŗ×ŖŅʵ½ČŻĮæĘæÖŠ”£
(4)ĻĀĮŠĒéæöÖŠ£¬»įŹ¹ĖłÅäČÜŅŗÅضČĘ«øߵďĒ___________(ĢīŠņŗÅ)”£
A.¶ØČŻŹ±¹Ū²ģŅŗĆęø©ŹÓ B.ƻӊ½ųŠŠÉĻŹöµÄ²Ł×÷²½Öč¢Ż
C.³ĘĮæµÄĒāŃõ»ÆÄĘŅŃ³±½ā D.ČŻĮæĘæŹ¹ÓĆĒ°ÄŚ±ŚÕ“ÓŠĖ®Öé
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚŅ»¶ØĪĀ¶ČĻĀ£¬Ä³ČŻ»ż²»±äµÄĆܱÕČŻĘ÷ÖŠ£¬½ØĮ¢ĻĀĮŠ»ÆŃ§Ę½ŗā£ŗC(s)£«H2O(g)![]() CO(g)£«H2(g)”£ĻĀĮŠŠšŹöÖŠ²»ÄÜĖµĆ÷ÉĻŹöæÉÄę·“Ó¦ŅŃ“ļµ½»ÆŃ§Ę½ŗāדĢ¬µÄŹĒ£Ø £©
CO(g)£«H2(g)”£ĻĀĮŠŠšŹöÖŠ²»ÄÜĖµĆ÷ÉĻŹöæÉÄę·“Ó¦ŅŃ“ļµ½»ÆŃ§Ę½ŗāדĢ¬µÄŹĒ£Ø £©
A. ĢåĻµµÄŃ¹Ēæ²»ŌŁ·¢Éś±ä»Æ
B. vÕż(CO)=vÄę(H2O)
C. Éś³Én mol COµÄĶ¬Ź±Éś³Én mol H2
D. 1molH”ŖH¼ü¶ĻĮѵÄĶ¬Ź±¶ĻĮŃ2molH”ŖO¼ü
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĶ¼ĖłŹ¾ĪŖ800”ꏱA”¢B”¢CČżÖÖĘųĢåŌŚĆܱÕČŻĘ÷ÖŠ·“Ó¦Ź±ÅØ¶ČµÄ±ä»Æ£¬Ö»“ÓĶ¼ÉĻ·ÖĪö²»ÄÜµĆ³öµÄ½įĀŪŹĒ(”” )
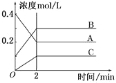
A£®AŹĒ·“Ó¦Īļ
B£®Ē°2 min AµÄ·Ö½āĖŁĀŹĪŖ0.1 mol”¤L£1”¤min£1
C£®Ē°2 min CµÄÉś³ÉĖŁĀŹĪŖ0.2 mol”¤L£1”¤min£1
D£®·“Ó¦µÄ·½³ĢŹ½ĪŖ£ŗ2A(g)![]() 2B(g)£«C(g)
2B(g)£«C(g)
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅ»¶ØĪĀ¶ČĻĀ£¬ŌŚČŻ»żĪŖVLµÄĆܱÕČŻĘ÷ÖŠ½ųŠŠ·“Ó¦£ŗaN(g)![]() bM(g)£¬M”¢NµÄĪļÖŹµÄĮæĖꏱ¼äµÄ±ä»ÆĒśĻßČēĶ¼ĖłŹ¾£ŗ
bM(g)£¬M”¢NµÄĪļÖŹµÄĮæĖꏱ¼äµÄ±ä»ÆĒśĻßČēĶ¼ĖłŹ¾£ŗ
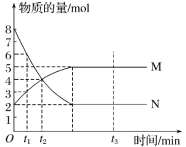
£Ø1£©“Ė·“Ó¦µÄ»Æѧ·½³ĢŹ½ÖŠ![]() £½____”£
£½____”£
£Ø2£©t1µ½t2Ź±æĢ£¬ŅŌMµÄÅØ¶Č±ä»Æ±ķŹ¾µÄĘ½¾ł·“Ó¦ĖŁĀŹĪŖ_____”£
£Ø3£©ĻĀĮŠŠšŹöÄÜĖµĆ÷ÉĻŹö·“Ó¦“ļµ½Ę½ŗāדĢ¬µÄŹĒ____(Ģī×ÖÄø)”£
A ·“Ó¦ÖŠMÓėNµÄĪļÖŹµÄĮæÖ®±ČĪŖ1”Ć1
B »ģŗĻĘųĢåµÄ×ÜÖŹĮæ²»Ėꏱ¼äµÄ±ä»Æ¶ų±ä»Æ
C »ģŗĻĘųĢåµÄ×ÜĪļÖŹµÄĮæ²»Ėꏱ¼äµÄ±ä»Æ¶ų±ä»Æ
D µ„Ī»Ź±¼äÄŚĻūŗÄa mol N£¬Ķ¬Ź±Éś³Éb mol M
E »ģŗĻĘųĢåµÄŃ¹Ēæ²»Ėꏱ¼äµÄ±ä»Æ¶ų±ä»Æ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÓŠ±ūČ²ŗĶĒāĘųµÄ»ģŗĻĘųĢå5L£¬ŌŚ“߻ƼĮ×÷ÓĆĻĀ£¬¾³ä·Ö·“Ó¦ŗóµĆµ½µÄĘųĢåµÄĢå»żĪŖV(ĖłÓŠĢå»ż¾łŌŚĶ¬ĪĀĶ¬Ń¹ĻĀ²ā¶Ø)”£
£Ø1£©Čō½«ÉĻŹö5LĘųĢåŌŚŃõĘųÖŠĶźČ«Č¼ÉÕÉś³É¶žŃõ»ÆĢ¼ŗĶĖ®£¬ĻūŗÄĶ¬ĪĀĶ¬Ń¹ĻĀŃõĘųµÄĢå»żV(O2)ĪŖ___(Ȕֵ·¶Ī§)”£
£Ø2£©ČōĒāĘųµÄĢå»żĪŖ1L£¬·“Ó¦ŗóµÄĢå»żV£½___L”£
£Ø3£©ČōĒāĘųŌŚ»ģŗĻĘųĢåÖŠµÄĢå»ż·ÖŹżĪŖx£¬ŹŌÓĆx±ķŹ¾·“Ó¦ŗóµÄĢå»żV=___”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĖ®ČÜŅŗXÖŠÖ»æÉÄÜČÜÓŠNa£«”¢Mg2£«”¢Al3£«”¢![]() ”¢
Ӣ![]() Ӣ
Ӣ![]() Ӣ
Ӣ![]() Ӣ
”¢![]() ÖŠµÄČōøÉÖÖĄė×Ó”£Ä³Ķ¬Ń§¶ŌøĆČÜŅŗ½ųŠŠĮĖČēĻĀŹµŃé£ŗ
ÖŠµÄČōøÉÖÖĄė×Ó”£Ä³Ķ¬Ń§¶ŌøĆČÜŅŗ½ųŠŠĮĖČēĻĀŹµŃé£ŗ
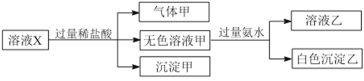
ĻĀĮŠÅŠ¶ĻÕżČ·µÄŹĒ
A.ĘųĢå¼×Ņ»¶ØŹĒ“æ¾»ĪļB.³Įµķ¼×ŹĒ¹čĖįŗĶ¹čĖįĆ¾µÄ»ģŗĻĪļ
C.Na£«”¢![]() ŗĶ
ŗĶ![]() Ņ»¶Ø“ęŌŚÓŚČÜŅŗXÖŠD.
Ņ»¶Ø“ęŌŚÓŚČÜŅŗXÖŠD.![]() ŗĶ
ŗĶ![]() Ņ»¶Ø²»“ęŌŚÓŚČÜŅŗXÖŠ
Ņ»¶Ø²»“ęŌŚÓŚČÜŅŗXÖŠ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ·“Ó¦4NH3£ØĘų£©£«5O2£ØĘų£©![]() 4NO£ØĘų£©£«6H2O£ØĘų£©ŌŚ10LĆܱÕČŻĘ÷ÖŠ½ųŠŠ£¬°ė·ÖÖÓŗó£¬Ė®ÕōĘųµÄĪļÖŹµÄĮæŌö¼ÓĮĖ0.45mol£¬Ōņ“Ė·“Ó¦µÄĘ½¾łĖŁĀŹ¦Ō (X)(·“Ó¦ĪļµÄĻūŗÄĖŁĀŹ»ņ²śĪļµÄÉś³ÉĖŁĀŹ)æɱķŹ¾ĪŖ( )
4NO£ØĘų£©£«6H2O£ØĘų£©ŌŚ10LĆܱÕČŻĘ÷ÖŠ½ųŠŠ£¬°ė·ÖÖÓŗó£¬Ė®ÕōĘųµÄĪļÖŹµÄĮæŌö¼ÓĮĖ0.45mol£¬Ōņ“Ė·“Ó¦µÄĘ½¾łĖŁĀŹ¦Ō (X)(·“Ó¦ĪļµÄĻūŗÄĖŁĀŹ»ņ²śĪļµÄÉś³ÉĖŁĀŹ)æɱķŹ¾ĪŖ( )
A. ¦Ō(NH3)=0.0100mol”¤L-1”¤s-1B. ¦Ō(O2)=0.0010 mol”¤L-1”¤s-1
C. ¦Ō(NO)=0.0010 mol”¤L-1”¤s-1D. ¦Ō(H2O)=0.045 mol”¤L-1”¤s-1
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com