
�Ӻ�ͭ�ḻ����Ȼ��Դ��ͭ��(CuFeS2)ұ��ͭ�Ĺ����������£�
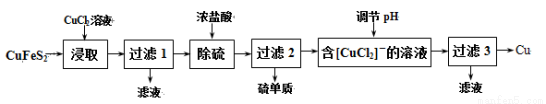
��֪��CuFeS2 + 3CuCl2��4CuCl�� + FeCl2 + 2S��
��1����ȡʱ��������FeCl3��Һ��Ҳ������CuCl��S���÷�Ӧ��ѧ����ʽΪ ��
��2��������1������Һ��ֻ��FeCl2�������ڿ����м������ɡ����պ����ù���Ļ�ѧʽΪ ��
��3��������Һ��pH������Cu�⣬���ܲ���һ�ֽ������ӣ��˽��������� ��(�����ӷ���)
��4������3������Һ�п���ѭ��ʹ�õ������� ��Ϊ�������̳���ѭ����ÿ����1molCu���������貹��CuCl2�����ʵ���Ϊ ��
��5��ұ�����ջ����Խ���ѡ��Ļ�ͭ��ɰ������ڸ��������գ�ʹ��ת��Ϊͭ����ѧ����ʽΪ��6CuFeS2+13O2 3Cu2S+2Fe3O4+9SO2 Cu2S+O2
3Cu2S+2Fe3O4+9SO2 Cu2S+O2 2Cu+SO2
2Cu+SO2
�˹�����ǰһ���������Ҫȱ���� ��
 �·Ƿ��̸����100��ϵ�д�
�·Ƿ��̸����100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016���Ĵ�ʡ�˱��ظ�����һ����Ӧ�Բ������ۻ�ѧ�Ծ��������棩 ���ͣ������
��⾫��ͭ���������к��ж��ֹ��ؽ�����������ȡ����������һ�ֹ������£�
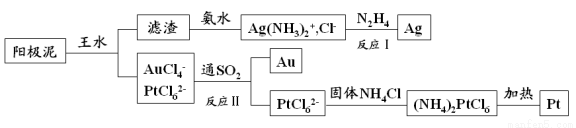
��1����ˮ�� �Ļ��Һ���������Ϊ ��
��2�������ijɷ��� ����Ӧ�����£�N2H4���������� ��
��3����Ӧ������ӷ���ʽΪ ��������19.7gAuʱ��25���101kPa�·�Ӧ���� L SO2���������µ�����Ħ�����Ϊ24.5L��mol�����ԭ������Au��197����
��4����ⷨ������ʱ������Ӧ��ֱ����Դ�� �������������������������AgNO 3 ��HNO 3 �����Һ���������Һʱ��������������������ɫ���壬�����������ĵ缫��ӦʽΪ ��
��5�����Ũ���ᷴӦ�Ļ�ѧ����ʽΪ��Au+6HNO3��Ũ��=Au��NO3��3+3NO2��+3H2O�����÷�Ӧ��ƽ�ⳣ����С�����Խ��Ũ���Ἰ������Ӧ������ȴ����������ˮ��ԭ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016��ɽ��ʡ����5��ģ��һ���ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����йص������Һ������Ũ�ȹ�ϵ��ȷ����
A��pH=a�Ĵ�����Һ��ϡ��10������pH=b����a=b-1
B���������ʵ�����NaHSO3��Na2SO3����Һ��2c(Na+)=3[c(HSO3-)+c(SO32-)+c(H2SO3)]
C��0.1mol��L-1������0.2mol��L-1��ˮ�������ϣ�c(NH3��H2O)>c(Cl-)>c(NH4+)>c(OH-)
D������AgCl��AgI���������Һ��c(Ag+)>c(Cl-)=c(I-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�꺣�ϼλ���ѧ�߶����������ƻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����л����ں˴Ź���������ֻ����һ������
A ��HCHO B ��CH3OH C��HCOOH D��CH3COOCH3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�콭��ʡ������ѧ�ڿ�ǰ��ϰ��ѧ�Ծ��������棩 ���ͣ������
�����ʽṹ�����ʡ�
ԭ������С��36��X��Y��Z��ͭ����Ԫ�أ�X�Ļ�̬ԭ����3����ͬ���ܼ�����һ���ܼ��еĵ����������������ܼ��еĵ���������1��Y��̬ԭ���еĵ���ռ��5�������������2��������ڰ����״̬��Z��ԭ������Ϊ24��
��1��Zԭ�ӻ�̬��������Ų�ʽΪ______________________________��
��2��Ԫ��X��Y�ĵ�һ�����ܽϴ����_________(��Ԫ�ط���)��H2Y2��Yԭ�ӹ�����ӻ�����Ϊ____��
��3��+3��Z�������K[Z(C2O4)2(H2O)2]�е�������_________����C2O42-��Ϊ�ȵ������һ�ַ��ӵĻ�ѧʽΪ_____________��
��4��Cu��Y�γɵĻ�����ľ�����ͼ��ʾ����������ͭ���Ӿ�������������ͭ������_______����ij����ȱ�ݵ�ͭ��Y�γɵĻ�����ľ�����Cu2+��Cu3+��Y2-����϶��ɣ��ɱ�ʾΪCu0.98Y����n(Cu2+)/n(Cu3+)=_______________��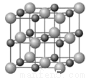
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�콭��ʡ������ѧ�ڿ�ǰ��ϰ��ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵����ȷ����

A����Ӧ3NO2(g)+H2O(l)=2HNO3(l)+NO(g)�������¿��Է����У���÷�Ӧ�ġ�H��0
B����ͭ�ĵ�⾫�������У���ת��1mol���ӣ��������ܽ�32gCu
C����������CuS������Һ�м��뱥��MnSO4��Һ������MnS��������Ksp(MnS))��Ksp(CuS)
D����������0.1mol/LNaOH��Һ�ֱ�ζ���ͬ���ʵ���Ũ�Ⱥ���ͬ���������ʹ��ᣬ����ʵ��(����ͼ)��ʾ���ǵζ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�콭��ʡ������ѧ�ڿ�ǰ��ϰ��ѧ�Ծ��������棩 ���ͣ�ѡ����
��ҵ�ϳ��������ۺ���������Ӧ���������졣����˵����ȷ����
A����������������������������
B���������е����뾶��r(Al3+)��r(O2-)
C���ڸ÷�Ӧ�У����Ļ�ԭ��ǿ�����Ļ�ԭ��
D��1mol �������μӷ�Ӧת�Ƶ�����ԼΪ4��6.02��1023
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ���Ĵ��ɶ�ʯ����ѧ�߶�4���¿���ѧ�Ծ��������棩 ���ͣ�ʵ����
����ԭ�Ϻ췯��(�ظ����ƣ�Na2Cr2O7•2H2O)��Ҫ���Ը�����(��Ҫ�ɷ�Ϊ FeO•Cr2O3��������A12O3��SiO2 ������)Ϊ��Ҫԭ������������Ҫ�����������£�
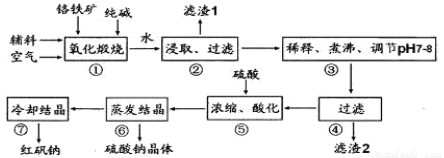
���������Ҫ��Ӧ�Ļ�ѧ����ʽΪ��4FeO•Cr2O3��8Na2CO3��7O2 =8Na2CrO4��2Fe2O3��8CO2
��1������ A12O3��SiO2�ڢ���ת����ˮ���˽�����Һ��д�� A12O3�ڢ���ת���Ļ�ѧ��Ӧ����ʽ____________________________________��
��2���û�ѧƽ���ƶ�ԭ��˵��������е�������____________(�����ӷ���ʽ�������˵��)
��3�������ữ��ʹ CrO42һת��Ϊ Cr2O72һ����1L�ữ��������Һ�к���Ԫ�ص�����Ϊ 28.6 g��CrO42-�� ת��Ϊ Cr2O72-��
ת��Ϊ Cr2O72-��
���ữ��������Һ�� c(Cr2O72- )��________
�ڹ�ҵ��Ҳ�����ͼʾװ��(������Ϊ���Ե缫)���Na2CrO4��Һ��ȡ Na2Cr2O7��ͼ���Ҳ�缫�ĵ缫��ӦʽΪ_________________________�������ǰ������Һ��������ȣ���������ת����1mol ����ʱ������Һ��������Ϊ______________g
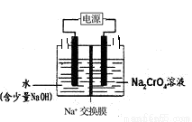
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016������ʡ���������һ��ģ�����ۻ�ѧ�Ծ��������棩 ���ͣ������
����ѧ����ѡ��2��ѧ�뼼�������Ṥҵ�ڹ�����ռ�м�����Ҫ�ĵ�λ��
��1����ҵ������ʱ�������������Ҫ�ɷ�ΪFeS2��������Ԫ�صĻ�����Ϊ ��
��2�������������������ǻ��ʹ�ҵ������������ij��������� (��дһ��)��
��3�����������У����ݻ�ѧƽ��ԭ����ȷ�����������ʩ�� (��д���)��
A����ʯ�������¯֮ǰ�ȷ��� B��ʹ��V2O5������
C��ת������ʹ�����˵��¶� D���������¯����Ҫ�й����Ŀ���
E���������ڳ�ѹ�½��� F������������98.3%��Ũ��������SO3
��4�������Ṥҵ�У�ͨ�����з�Ӧʹ��������ת��Ϊ��������
2SO2(g)��O2(g) 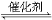 2SO3(g)�� ��H����98.3 kJ��mol��1
2SO3(g)�� ��H����98.3 kJ��mol��1
��ʵ�ʹ�ҵ�����У������á���ת����������������һ��ת�����ɵ�SO2�����δת����SO2���ж���ת������������SO2��ת���ʾ�Ϊ95%��������SO2��ת����Ϊ ��
��5������Ĺ�ҵ�Ʒ������漰������Ҫ�Ļ�ѧ��Ӧ����Ӧ���豸(����¯��ת������������))��
�������豸�ֱ�ʹ��Ӧ��֮����������������ˡ�����������������������з�Ӧ��֮�������������ġ�
____________________________________________________________________��
�ڹ�ҵ�����г��ð����ᷨ����β�������Դﵽ������Ⱦ���������õ�Ŀ�ġ��û�ѧ����ʽ��ʾ�䷴Ӧԭ����(ֻд��2������ʽ����)
______________________________________________________________________
_____________________________________________________________________��
��6��ʵ���ҿ��������᳧¯��(��Ҫ�ɷ�Ϊ���������P����FeS��SiO2��)�Ʊ��������̷�(FeSO4•7H2O)�������Ļ�ѧʽΪ[Fe2(OH)n(SO4)3��0.5n]m���Ʊ�������ͼ��ʾ������˵����ȷ���� ��
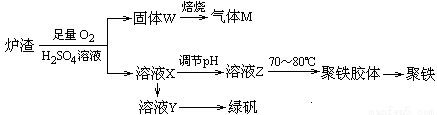
A��¯����FeS������������ķ�Ӧ�����ӷ���ʽΪ��4FeS+3O2+12H+�T4Fe3++4S��+6H2O
B������M�ijɷ���SO2��ͨ��˫��ˮ�õ����ᣬ��ѭ��ʹ��
C������ҺX�м���������ۣ���ַ�Ӧ����˵õ���ҺY���ٽ���ҺY�����ᾧ���ɵõ��̷�
D����ҺZ��pHӰ�������������������������pHƫС�������¾�����������������ƫ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com