
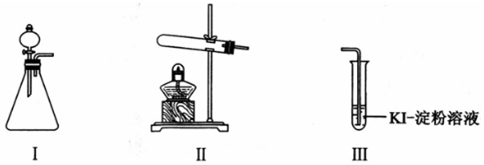
| 操作 | 现象 | |
| 甲 | 向I的锥形瓶中加入MnO2固体,.向I的分液漏斗中加入30% H2O2溶液,连接I、Ⅲ,打开活塞 | I中产生无色气体并伴随大量白雾;Ⅲ中有气泡冒出,溶液迅速变蓝 |
| 乙 | 向Ⅱ中加入KMnO4固体,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液不变蓝 |
| 丙 | 向Ⅱ中加入KMnO4固体,Ⅲ中加入适量0.1mol/L H2SO4溶液,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液变蓝 |
分析 (1)甲实验:根据装置Ⅰ不需要加热制取氧气可知利用的是双氧水的分解,过氧化氢在二氧化锰催化作用下分解生成氧气,I中产生无色气体并伴随大量白雾;Ⅲ中有气泡冒出,溶液迅速变蓝说明生成碘单质;
(2)碘离子具有还原性,在酸性条件下能够被氧化氧化成碘单质,据此写出反应的离子方程式;
(3)对比乙、丙实验可知,O2与KI溶液发生反应的适宜条件酸性环境,酸溶液中氢离子浓度不同,装置Ⅲ中出现蓝色的速率不同;
(4)证明Ⅰ中产生的气体中含有双氧水,氧气和双氧水都具有氧化性,需要利用不同性质进行检验;
(5)该小组同学取20mL久置的KI溶液,向其中加入几滴淀粉溶液,结果没有观察到溶液颜色变蓝,可能是生成的碘单质在件容易中发生反应生成碘化钾、碘酸钾,验证是否正确在未变蓝色的溶液中滴入稀硫酸观察是否变蓝验证.
解答 解:(1)甲实验:根据装置Ⅰ不需要加热制取氧气可知利用的是双氧水的分解,过氧化氢在二氧化锰催化作用下分解生成氧气,向I的锥形瓶中加入MnO2固体,向I的分液漏斗中加入30% H2O2溶液,连接I、Ⅲ,打开活塞,I中产生无色气体并伴随大量白雾;Ⅲ中有气泡冒出,溶液迅速变蓝说明生成碘单质,
故答案为:MnO2固体;分液漏斗;
(2)碘离子具有还原性,在酸性条件下能够被氧化氧化成碘单质,据此写出反应的离子方程式为:O2+4I-+4H+=2I2+2H2O,
故答案为:O2+4I-+4H+=2I2+2H2O;
(3)向Ⅱ中加入KMnO4固体,连接Ⅱ、Ⅲ,点燃酒精灯,Ⅲ中有气泡冒出,溶液不变蓝,向Ⅱ中加入KMnO4固体,Ⅲ中加入适量0.1mol/L H2SO4溶液,连接Ⅱ、Ⅲ,点燃酒精灯,Ⅲ中有气泡冒出,溶液变蓝对比乙、丙实验可知,O2与KI溶液发生反应的适宜条件是:酸性环境;为进一步探究该条件对反应速率的影响,可采取的实验措施是:使用不同浓度的稀硫酸作对比实验,
故答案为:酸性环境;使用不同浓度的稀硫酸作对比实验;
(4)A.KMnO4,高锰酸钾溶液能够将双氧水氧化,导致高锰酸钾溶液褪色,而氧气不与高锰酸钾溶液反应,如果高锰酸钾溶液褪色可证明混合气体中含有双氧水,故A正确;
B.FeCl2,氧气和高锰酸钾溶液都能够氧化亚铁离子,无法证明混合气体中含有双氧水,故B错误;
C.Na2S,高锰酸钾和氧气都能够氧化硫化钠,无法用硫化钠检验混合气体中是否含有双氧水,故C错误;
D.品红遇到过氧化氢会被氧化红色褪去,证明混合气体中含有双氧水,故D正确;
故答案为:AD;
(5)KI溶液在空气中久置过程中会被缓慢氧化:4KI+O2+2H2O=2I2+4KOH.该小组同学取20mL久置的KI溶液,向其中加入几滴淀粉溶液,结果没有观察到溶液颜色变蓝,他们猜想可能是发生了反应的离子方程式为:3I2+6OH-=5I-+IO3-+3H2O,设计实验证明他们的猜想是否正确升温方案为:在上述未变蓝的溶液中滴入0.1mol/LH2SO4溶液观察现象,若溶液变蓝则猜想正确,否则错误,
故答案为:3I2+6OH-=5I-+IO3-+3H2O;在上述未变蓝的溶液中滴入0.1mol/LH2SO4溶液观察现象,若溶液变蓝则猜想正确,否则错误.
点评 本题考查物质性质实验方案的设计和分析,侧重于学生的分析能力、实验能力和计算能力的考查,为高考高频考点,注意把握物质的性质以及实验的方法和原理,题目难度中等.


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案科目:高中化学 来源: 题型:多选题
| 实验目的 | 实验操作 | |
| A | 区分苯和四氯化碳 | 在两支分别盛有少量苯和四氯化碳的试管中加碘水后振荡 |
| B | 证明溴乙烷中有溴原子 | 溴乙烷与NaOH水溶液共热,充分反应,冷却后加入硝酸银溶液 |
| C | 制取溴苯 | 在苯中加铁粉后再加溴水并振荡 |
| D | 除去苯中的甲苯 | 向混合物中加入酸性高锰酸钾溶液,然后分液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | X可用于合成高分子化合物,Y不能合成高分子化合物 | |
| B. | X在烧碱溶液中变质,而Y在烧碱溶液中不变质 | |
| C. | X分子中所有原子均可能共平面 | |
| D. | X和Y分别与浓硝酸反应都能生成5种二硝基取代物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+=Cu2++2Fe2+ | |
| B. | Na2O2与H2O反应制备O2:Na2O2+H2O=2Na++2OH-+O2↑ | |
| C. | 硫化钠水溶液呈碱性的原因:S2-+2H2O?H2S↑+2OH- | |
| D. | 铝粉与NaOH溶液反应产生H2:2A1+2OH-+2H2O=2Al(OH)3↓+3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳原子数 | B. | 烷基位置编号 | C. | 氢原子数 | D. | 同种烷基数目 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油分馏是物理变化,可获得汽油、煤油、柴油等产品 | |
| B. | C4H9Cl、C4H8Cl2的同分异构体种类分别有4种、9种(不含立体异构) | |
| C. | 淀粉和纤维素水解的最终产物不同 | |
| D. | 由乙酸生成乙酸乙酯属于取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LH2O2中所含H原子个数远大于2NA | |
| B. | 常温常压下,14.2g的Na2SO4和Na2S2O3的混合物含有Na原子个数为O.4NA | |
| C. | 标准状况下,1.5mol的MnO2粉末与足量浓盐酸共热转移电子数目小于3NA | |
| D. | 3.6gD2O所含质子数为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com