
【题目】实验室欲探究CO还原CuO,设计如图所示装置(夹持装置略去)。下列说法正确的是

A. ②、④中均可盛装碱石灰
B. 加热的顺序为③、①、⑤
C. ①、③、⑤中均发生氧化还原反应
D. 可将尾气用导管通入到⑤的酒精灯处灼烧
【答案】D
【解析】由装置图可知,NaHCO3受热分解生成Na2CO3、H2O和CO2,用装置②除去CO2中混有的H2O(g),CO2与碳粉加热反应生成CO,用装置④除去剩余的CO2,CO与CuO固体加热反应生成CO2和Cu,最后进行尾气处理除去剩余的CO。A. ②中若盛装碱石灰,会把CO2和H2O(g)一并除去,因此②中应盛装P2O5等干燥剂,装置④的作用是除去剩余的CO2,所以装置④中可盛装碱石灰,故A错误;B. 因碳粉会和空气中的氧气、水蒸气等在加热时发生反应,所以应先加热装置①,待整个装置中充满CO2时,再加热③和⑤,故B错误;C. 装置①中发生的是NaHCO3受热分解生成Na2CO3、H2O和CO2的反应,该反应中没有元素化合价发生变化,不是氧化还原反应,③中发生的反应为C+CO2![]() 2CO、⑤中发生的反应为CO+CuO
2CO、⑤中发生的反应为CO+CuO![]() Cu+CO2,这两个反应中均有元素化合价发生变化,属于氧化还原反应,故C错误;D. 处理尾气CO通常采用点燃的方法,使CO燃烧生成无污染的CO2,故D正确;答案选D。
Cu+CO2,这两个反应中均有元素化合价发生变化,属于氧化还原反应,故C错误;D. 处理尾气CO通常采用点燃的方法,使CO燃烧生成无污染的CO2,故D正确;答案选D。


科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的认识不正确的是
A. 油脂在空气中完全燃烧转化为水和二氧化碳
B. 蔗糖、麦芽糖的分子式都是C12H22O11,二者互为同分异构体
C. 在水溶液里,乙酸分子中的—CH3可以电离出H+
D. 在浓硫酸存在下,苯与浓硫酸共热生成硝基苯的反应属于取代反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)金刚烷的结构如图1所示,它可看作是由四个等同的六元环组成的空间构型。
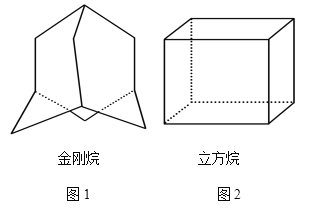
①金刚烷的分子式为________;
②根据中学学过的同分异构体判断规则,判断由溴原子取代分子中的氢原子形成的一溴代物有_____种。
(2)“立方烷”是一种新合成的烃,其分子为正方体结构,其碳架结构如图2所示。
①立方烷的分子式为______________________;
②该立方烷的二氯代物具有同分异构体的数目是_____________;
③将a g立方烷溶于b mL苯中,然后通入c L乙炔(标准状况下),所得混合物中碳的百分含量为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)在不同条件下分解产物不同,200 ℃时在Cu表面分解的机理如图甲所示。已知200 ℃时:
反应Ⅰ:3N2H4(g)===N2(g)+4NH3(g) ΔH1=-32.9 kJ·mol-1
反应Ⅱ:N2H4(g)+H2(g)===2NH3(g) ΔH2=-41.8 kJ·mol-1
下列说法中不正确的是 ( )
A.图所示过程①、②都是放热反应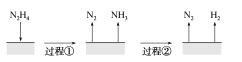
B.反应Ⅱ的能量过程示意图如图所示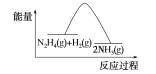
C.断裂3 mol N2H4(g)中的化学键吸收的能量小于形成1 mol N2(g)和4 mol NH3(g)中的化学键释放的能量
D.200 ℃时,肼分解生成氮气和氢气的热化学方程式为N2H4(g)===N2(g)+2H2(g) ΔH=+50.7 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.如何降低大气中CO2的含量及有效利用CO2,目前已引起各国普遍重视。
(1)工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1molCO2和3molH2,在500℃下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。实验测得CO2(g)和CH3OH(g)的浓度随时间变化如图1所示。
CH3OH(g)+H2O(g)。实验测得CO2(g)和CH3OH(g)的浓度随时间变化如图1所示。
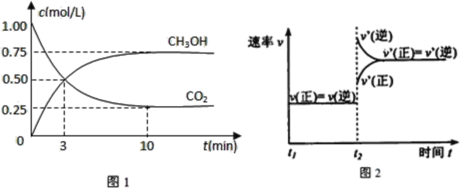
①从反应开始到平衡,氢气的平均反应速率v(H2)=__;
②图2是改变温度时H2的化学反应速率随时间变化的示意图,则该反应的正反应是__热(填“吸”或“放”)反应。
③该反应的平衡常数K为__(保留两位小数)。若提高温度到800℃进行,达平衡时,K值__(填“增大”、“减小”或“不变”),
④500℃达平衡时,CH3OH的体积分数ω为__。
Ⅱ.(2)工业上可利用煤的气化产物(CO和H2)合成二甲醚(CH3OCH3),其三步反应如下:
①2H2(g)+CO(g)![]() CH3OH(g) △H=-90.8kJmol-1
CH3OH(g) △H=-90.8kJmol-1
②2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H=-23.5kJmol-1
CH3OCH3(g)+H2O(g) △H=-23.5kJmol-1
③CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-41.3kJmol-1
CO2(g)+H2(g) △H=-41.3kJmol-1
总合成反应的热化学方程式为__。
(3)一定条件下的密闭容器中,上述总反应达到平衡时,要提高CO的转化率,可以采取的措施是__(填字母代号)。
A.高温高压
B.加入催化剂
C.减少CO2的浓度
D.增加CO的浓度
E.分离出二甲醚
(4)已知反应②2CH3OH(g)![]() CH3OCH3(g)+H2O(g)在某温度下的平衡常数K=400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)在某温度下的平衡常数K=400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
c/molL-1 | 0.44 | 0.60 | 0.60 |
此时,v(正)__v(逆)(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某密闭容器中加入0.15 mol·L-1 A、0.05 mol·L-1 C和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如图中甲图所示[t0~t1时c(B)未画出,t1时c(B)增大到0.05 mol·L-1]。乙图为t2时刻后改变反应条件,平衡体系中正、逆反应速率随时间变化的情况。
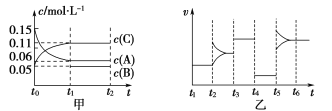
(1)若t4时改变的条件为减小压强,则B的起始物质的量浓度为___mol·L-1。
(2)若t5时改变的条件是升温,此时v(正)>v(逆),若A的物质的量减少0.03 mol时,容器与外界的热交换总量为a kJ,写出反应的热化学方程式:___________________________________。
(3)t3时改变的某一反应条件可能是________(填字母)。
a.使用催化剂 b.增大压强 c.增大反应物浓度
(4)在恒温恒压下通入惰性气体,v(正)________v(逆)(填“>”“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过以下反应可获得新型能源二甲醚(![]() )。下列说法不正确的是
)。下列说法不正确的是
①![]()
![]()
②![]()
![]()
③![]()
![]()
④![]()
![]()
A. 反应①、②为反应③提供原料气
B. 反应③也是![]() 资源化利用的方法之一
资源化利用的方法之一
C. 反应![]() 的
的![]()
D. 反应![]() 的
的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“位置”、“结构”和“性质”是我们学习元素周期律的重要思路。
(1)我们可以根据原子结构示意图来推测元素在周期表中的位置,以下为X元素的原子结构示意图(未画全):

请写出X元素在周期表中的位置_____________________。
(2)我们也可以根据物质性质推测该元素在元素周期表中的位置,如Y元素最高价氧化物既可以溶于浓盐酸,也可以溶于NaOH溶液;其最高价氧化物对应的水化物既可以与酸反应,也可以与碱反应;1mol该元素最高价氧化物对应的水化物在与盐酸反应时,最多能消耗4molHCl。请写出Y元素在周期表中的位置_____________________。
(3)反过来,知道了元素的位置关系,我们可以推测元素性质或者元素对应的单质及化合物的性质。四种短周期元素在周期表中的位置如下图所示,其中只有M为金属元素。则Y和Z原子半径更大的是____(填元素符号或化学式,下同),Y和X最高价氧化物对应水化物的酸性更弱的是______。
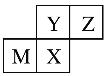
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com