

分析 (1)若不考虑热量耗散,物料转化率均为100%,最终炉中出来的气体只有CO.则为了维持热平衡,所以每生产1molCaC2,则投料的量为:1molCaO、而投入碳的量为:3mol+$\frac{464.1kJ}{110.5kJ•mo{l}^{-1}}$=7.2mol,氧气的物质的量为$\frac{464.1kJ}{110.5kJ•mo{l}^{-1}}$×$\frac{1}{2}$=2.1mol,2.1mol氧气化合价降低8.4,1molCaC2化合物价降低2.0,共降低价数为10.4mol;
(2)由反应,①CaO(s)+C(s)?Ca(g)+CO(g)△H1=a kJ•mol-1;②Ca(g)+2C(s)?CaC2(s)△H2=b kJ•mol-1;根据盖斯定律,目标反应的反应热为:①×2-②得△H3=(2a-b)kJ•mol-1,K1=$\sqrt{K2K3}$;
(3)①根据三步法列出起始、变化和平衡时的物质的量,再根据气体的体积分数等于气体的物质的量分数计算;相同温度下,压强增大,H2S分解反应逆向进行,所以P1小于P2;
②反应池中H2S与S2O82-发生氧化还原反应;电解池中硫酸根离子失去电子,氢离子得到电子,以此来解答.
解答 解:(1)若不考虑热量耗散,物料转化率均为100%,最终炉中出来的气体只有CO.则为了维持热平衡,所以每生产1molCaC2,则投料的量为:1molCaO、而投入碳的量为:3mol+$\frac{464.1kJ}{110.5kJ•mo{l}^{-1}}$=7.2mol,氧气的物质的量为$\frac{464.1kJ}{110.5kJ•mo{l}^{-1}}$×$\frac{1}{2}$=2.1mol,2.1mol氧气化合价降低8.4,1molCaC2化合物价降低2.0,共降低价数为10.4mol,
故答案为:10.4;
(2)由反应,①CaO(s)+C(s)?Ca(g)+CO(g)△H1=a kJ•mol-1;②Ca(g)+2C(s)?CaC2(s)△H2=b kJ•mol-1;根据盖斯定律,目标反应=①×2-②,K1=$\sqrt{K2K3}$;反应热c=(2a-b)kJ•mol-1,
故答案为:$\sqrt{K2K3}$;(2a-b);
(3)①H2S起始浓物质的量为2mol,测定H2S的转化率,T1时H2S的转化率为40%,则
H2S(g)?H2(g)+1/2S2(g)
开始 2 0 0
转化0.8 0.8 0.4
平衡1.2 0.8 0.4
根据气体的体积分数等于气体的物质的量分数,P1时平衡体系中H2的体积分数=$\frac{0.8}{1.2+0.8+0.4}×100%$=33.3%;
相同温度下,压强增大,H2S分解反应逆向进行,所以P1小于P2;
故答案为:=33.3%;小于;相同温度下,压强增大,H2S分解反应逆向进行,所以P1小于P2;
②反应池中H2S与S2O82-发生氧化还原反应,离子方程式为H2S+S2O82-=S↓+2SO42-+2H+;电解池中硫酸根离子失去电子生成S2O82-,2SO42--2e-=S2O82-,
故答案为:H2S+S2O82-=S↓+2SO42-+2H+;2SO42--2e-=S2O82-.
点评 本题考查学生化学平衡常数、盖斯定律、化学平衡移动的影响和化学方程式的书写及计算方面的知识,综合性强,难度较大.


 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②⑤⑥⑦ | B. | ①②③⑥⑦ | C. | ①④⑤⑥⑦ | D. | ①②⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
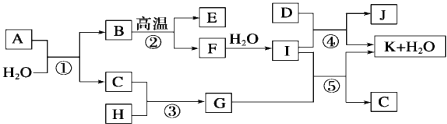
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液与K+、NO3-、OH-可以大量共存 | |
| B. | 该溶液显碱性的原因为ClO-+H2O?HClO+OH- | |
| C. | 向该溶液中滴入少量FeSO4溶液,反应的离子方程式为:2Fe2++ClO-+2H+═Cl-+2Fe3++H2O | |
| D. | 向该溶液中加入浓盐酸,每产生1molCl2,转移电子约为6.02×1023个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
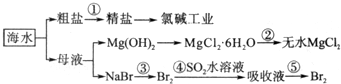
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2溶液中加入过量Al2(SO4)3溶液:3Ba2++6OH-+2Al3++3SO42-═3 BaSO4↓+2Al(OH)3↓ | |
| B. | 将少量CO2通入NaClO溶液中:ClO-+CO2+H2O═HCO3-+HClO (已知:次氯酸的Ka为2.95×10-8,碳酸的Ka2为5.6×10-11) | |
| C. | 次氯酸钙溶液中通入足量SO2:Ca2++ClO-+SO2+H2O═CaSO4↓+Cl-+2H+ | |
| D. | 向Ca(OH)2溶液中加入过量的NaHCO3溶液:Ca2++2HCO3-+2OH-═CO32-+CaCO3↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
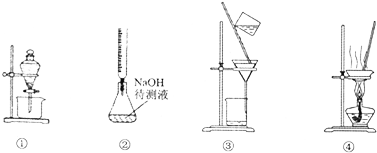
| A. | 图①表示分离CCl4和水的混合溶液的装置 | |
| B. | 图②表示已知浓度的盐酸溶液滴定未知浓度的氢氧化钠溶液的装置 | |
| C. | 图③表示分离二氧化锰和氯化锰溶液的装置 | |
| D. | 图④表示蒸干氯化铝溶液制AlCl3的装置 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com