
| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
| A、升高温度,水的电离平衡常数增大 |
| B、1mol/L的NaHCO3溶液中:c(HCO3-)+c(CO32-)+c(H2CO3)=1mol/L |
| C、常温时,饱和AgCl溶液与饱和AgI溶液相比,前者的c(Ag+)大 |
| D、在醋酸溶液中加入少量醋酸钠固体,能促进醋酸的电离 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、生成是水分子中含有18O |
| B、生成的乙酸乙酯相对分子质量为88 |
| C、生成的乙酸乙酯的相对分子质量为90 |
| D、此反应是有限度的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
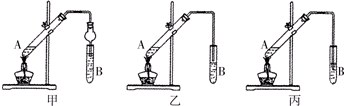
 可用图示装置制取少量乙酸乙酯(酒精灯等在图中均已略去)请填空:
可用图示装置制取少量乙酸乙酯(酒精灯等在图中均已略去)请填空:查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 预期实验目的或结论 |
| A | 室温下,用pH试纸测定浓度为0.1mol?L-1 Na2SiO3溶液和Na2CO3溶液的pH | 比较H2SiO3和H2CO3的酸性强弱 |
| B | 某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中含有SO42- |
| C | 向某溶液中加入2滴KSCN溶液,溶液不显红色.再向溶液中加入几滴新制的氯水,溶液变为红色 | 该溶液中一定含有Fe2+ |
| D | 将某气体通入淀粉和KI的混合溶液,溶液变蓝色 | 该气体一定是Cl2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、进行H2O和H2S的热分解实验,确定硫和氧两种元素的非金属性强弱 | ||
| B、HCl溶液的酸性比H2S溶液的酸性强,则Cl的非金属性比S强 | ||
C、2C+SiO2
| ||
| D、测定NaCl和NaF溶液的pH,可确定F、Cl两元素非金属性的强弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com