
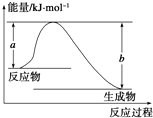
 断开1mol AB(g)分子中的化学键使其分别生成气态A原子和气态B原子所吸收的能量称为A-B键的键能.下表列出了一些化学键的键能E:
断开1mol AB(g)分子中的化学键使其分别生成气态A原子和气态B原子所吸收的能量称为A-B键的键能.下表列出了一些化学键的键能E:| 化学键 | H-H | Cl-Cl | O═O | C-Cl | C-H | O-H | H-Cl |
| E/kJ?mol-1 | 436 | 247 | x | 330 | 413 | 463 | 431 |
| 1 |
| 2 |
| x |
| 2 |
| ||
| 催化剂 |
| 1 |
| 4 |
| ||
| 催化剂 |


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
| A、在一定的温度和压强下,各种气态物质体积大小由气体分子的大小决定 |
| B、在一定的温度和压强下,各种气态物质体积的大小由物质的量的多少决定 |
| C、不同的气体,若体积不同,则它们所含的分子数一定不同 |
| D、气体摩尔体积是指1 mol任何气体所占的体积约为22.4 L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.01mol/L CH3COOH与pH=12的NaOH溶液混合,若混合后c(CH3COO-)>c(Na+),则混合液一定呈碱性 |
| B、常温下,将等体积0.01mol/L HCl与pH=12的氨水混合,则混合液的pH=7 |
| C、0.1mol/L的某二元弱酸盐Na2A溶液中,c(Na+)=2c(H2A)+2c(HA-)+2c(A2-) |
| D、将5mL 0.02mol/L的H2SO4与5mL 0.02mol/L NaOH溶液充分混合,若混合后溶液的体积为10mL,则混合液的pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 |
0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、两种气体的压强相等 |
| B、两种气体的氮原子数目不相等 |
| C、两种气体的分子数目相等 |
| D、NO比NO2的质量小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com