

分析 氟碳铈矿主要化学成分为CeFCO3,用硫酸强化焙烧得浸出液中含有氟离子、铈离子、硫酸等,尾气中主要含有二氧化碳,加入碳酸钙会生成硫酸钙和氟化钙等难溶物为滤渣,和硫酸稀土溶液,在硫酸稀土溶液中加入萃取剂,经过分液将溶液中的Ce3+萃取出来,再加入稀硫酸得含有Ce3+的溶液,调节溶液的pH值得Ce(OH)3沉淀,再经过氧气氧化,过滤、洗涤、干燥可得Ce(OH)4产品,以此解答该题.
解答 解:(1)+4价的铈的氧化物有很强的氧化性,应用稀硫酸酸浸,如加入盐酸,Ce4+离子具有强氧化性,可将Cl-氧化为Cl2,应避免污染环境、腐蚀设备,
故答案为:b;避免污染环境、腐蚀设备;
(2)根据题意可知应为KBF4沉淀,离子方程式为K++BF4-=KBF4↓,故答案为:K++BF4-=KBF4↓;
(3)萃取操作所用到的主要玻璃仪器名称是分液漏斗,在操作I后的溶液中加入NaOH溶液是为了调节溶液pH 获得Ce(OH)3和Ce(OH)4,实验室测定PH的方法是撕下一小片pH试纸放在干燥洁净的表面皿上,用玻璃棒蘸取该溶液点在pH试纸的中央,然后与标准比色卡对比,
故答案为:分液漏斗; Ce(OH)4;撕下一小片pH试纸放在干燥洁净的表面皿上,用玻璃棒蘸取该溶液点在pH试纸的中央,然后与标准比色卡对比;
(4)根据流程结合元素守恒可知Ce(OH)3结合氧气和水生成Ce(OH)4,反应的化学方程式为4Ce(OH)3+O2+2H2O=4Ce(OH)4,
故答案为:4Ce(OH)3+O2+2H2O=4Ce(OH)4.
点评 本题考查物质的制备.为高考常见题型和高频考点,侧重考查学生的分析、实验能力,题目既有常规知识的考查又有新情景题目的考查,常规题目涉及到影响化学反应速率的因素、过滤操作以及PH的测定方法;命题情景要求根据题意写出有关反应的方程式,做题时注意根据物质的性质正确判断反应物和生成物,用守恒的方法去书写.


科目:高中化学 来源: 题型:选择题
| A. | 己烷有4种同分异构体,它们的熔点、沸点各不相同 | |
| B. | 在一定条件下,苯与液溴、浓硝酸、浓硫酸作用生成溴苯、硝基苯、苯磺酸的反应都属于取代反应 | |
| C. | 将少量钠投入到盛有水和乙醇的烧杯中,比较水和乙醇中氢的活泼性 | |
| D. | 聚合物 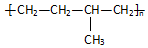 可由单体CH3CH=CH2和CH2=CH2加聚制得 可由单体CH3CH=CH2和CH2=CH2加聚制得 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
. =O$→_{H+}^{ROH}$
=O$→_{H+}^{ROH}$
 ,需要经历的反应类型有①②③④(填写编号).①加成反应 ②消去反应 ③取代反应 ④氧化反应 ⑤还原反应.写出制备化合物
,需要经历的反应类型有①②③④(填写编号).①加成反应 ②消去反应 ③取代反应 ④氧化反应 ⑤还原反应.写出制备化合物  的最后一步反应的化学方程式
的最后一步反应的化学方程式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
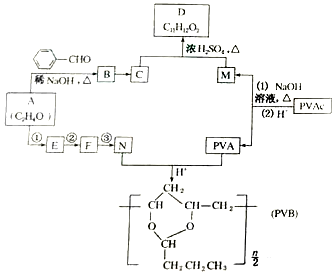
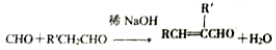 (R、R′表示烃基或氢)
(R、R′表示烃基或氢)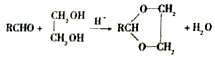
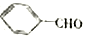 合成B的化学方程式是
合成B的化学方程式是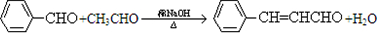 .
.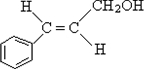 .
.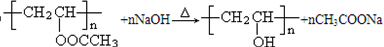 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 700℃ | 900℃ | |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节.回答下列问题:
氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com