
分析 (1)根据盖斯定律,反应②×2-③即得,确定反应④2CO(g)+2NO(g)?N2(g)+2CO2(g),据此计算焓变;
(2)根据反应①的方程式结合平衡常数表达式书写方法解答;
(3)化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,据此解答;
(4)依据反应CO(g)+$\frac{1}{2}$O2(g)?CO2(g)为放热的、熵减小的反应特点判断;
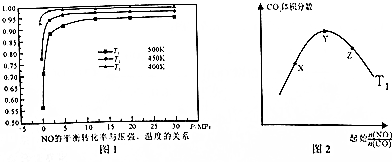
(5)根据图象分析,常压下NO的转化率已经较高,并且高压转化率增加不大,但增加成本较大,据此分析;
(6)温度一定,随反应物NO、CO的起始物质的量比增大,X-Y反应正向进行,一氧化碳的转化率X<Y,Y-Z平衡正向进行,一氧化氮增大会提高一氧化碳的转化率,则Y<Z;
②根据图象1分析,温度越低NO的平衡转化率越大,说明该反应为放热反应,所以温度越低,平衡时二氧化碳的体积分数也越大,据此画图.
解答 解:(1)根据盖斯定律,反应②×2-③即得,确定反应④2CO(g)+2NO(g)?N2(g)+2CO2(g)△H4=(2c-a)KJ/mol,
故答案为:2c-a;
(2)根据反应①的方程式得出Kp=$\frac{{p}^{2}(NO)}{P({N}_{2})P({O}_{2})}$,故答案为:Kp=$\frac{{p}^{2}(NO)}{P({N}_{2})P({O}_{2})}$;
(3)A.单位时间内生成1mol NO2的同时消耗了1mol NO,都是正反应,故不能说明达到平衡状态,故A错误;
B.依据ρ=$\frac{m}{V}$,气体的总质量一定,体积一定,故密度保持不变,故混合气体的密质不再发生改变不能说明达到平衡状态,故B错误;
C.2NO(g)+O2(g)=2NO2(g)为反应前后气体体积改变的反应,在恒温恒压的容器中,容器的体积保持不变,可以证明反应达到平衡状态,故C正确;
D.混合气体的容器中,容器的体积保持不变,依据M=$\frac{m}{n}$,气体的总质量不变,2NO(g)+O2(g)=2NO2(g)为反应前后气体体积改变的反应,则物质的量n改变,平均摩尔质量未到达平衡前始终变化,只有达到平衡才能保持不变,所以可以证明反应达到平衡状态,故C正确;
故选:CD;
(4)反应CO(g)+$\frac{1}{2}$O2(g)?CO2(g)为放热的、熵减小的反应,要使△H-T△S<0,则高温时不利于自发进行,故答案为:高温;
(5)根据图象分析,常压下NO的转化率已经较高,并且高压转化率增加不大,但增加成本较大,
故答案为:常压下NO的转化率已经较高,并且高压要增加成本;
(6)①温度一定,随反应物NO、CO的起始物质的量比增大,X-Y反应正向进行,一氧化碳的转化率X<Y,Y-Z平衡正向进行,一氧化氮增大会提高一氧化碳的转化率,则Y<Z,X、Y、Z三点,CO的转化率的从大到小的顺序Z>Y>X,
故答案为:Z>Y>X;
②根据图象1分析,温度越低NO的平衡转化率越大,说明该反应为放热反应,所以温度越低,平衡时二氧化碳的体积分数也越大,又T2<T1,所以温度为T2时的变化趋势曲线为: ,故答案为:
,故答案为: .
.
点评 本题考查了盖斯定律计算,平衡常数表达式的书写,化学平衡状态的判断,反应自发进行的判断依据,题目难度中等,侧重考查学生分析问题、解决问题的能力.


科目:高中化学 来源: 题型:选择题
| A. | 可喷洒到教室中进行环境消毒 | |
| B. | 和碘化钾淀粉溶液反应,溶液呈蓝色 | |
| C. | 加人足量烧碱后漂白性会消失 | |
| D. | 能使品红溶液褪色,加热红色恢复 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,pH>7的醋酸和醋酸钠的混合溶液中:c(CH3COO-)>c(Na+) | |
| B. | 将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后的溶液中:c(Na+)=c(Cl-) | |
| C. | 等pH的氨水、KOH溶液、Ba(OH)2溶液中:c(NH${\;}_{4}^{+}$)=c(K+)=c(Ba2+) | |
| D. | 0.2mol•L-1某一元弱酸HA溶液和0.1mol•L-1NaOH溶液等体积混合后的溶液:2c(OH-)+c(A-)=2c(H+)+c(HA) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向溶液中通入氯气:Ca2+、CH3COO-、Br-、Na+ | |
| B. | 碱性溶液:Na+、SO42-、Cl-、ClO- | |
| C. | 加入浓盐酸的溶液:Fe2+、K+、NO3-、NH4+ | |
| D. | 由水电离出的c(H+)=1×10-12的溶液:K+、Ca2+、Br-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 为验证铜与稀硝酸反应的还原产物是NO而不是NO2.某同学设计了如图所示的装置,下列叙述错误的是( )
为验证铜与稀硝酸反应的还原产物是NO而不是NO2.某同学设计了如图所示的装置,下列叙述错误的是( )| A. | 应先打开活塞和旋塞再从U型管右侧加入稀硝酸 | |
| B. | 加入的稀硝酸应充满U型管左侧 | |
| C. | 关闭旋塞后铜丝会全部溶解 | |
| D. | 反应停止后打开活塞,气体变成红棕色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将28.6 g Na2CO3•10H2O溶于100 mL蒸馏水中,可以配成100 mL 1.0 mol/L Na2CO3溶液 | |
| B. | 可以用重结晶法除去KNO3固体中混杂的NaCl,这是因为NaCl在水中的溶解度很大 | |
| C. | 用润湿的pH试纸测稀酸溶液的pH,测定值偏小 | |
| D. | 金属Mg与CO2和稀硫酸均能反应,其反应类型相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com