
| 实验目的 | 实验编号 | 温度 | 金属铝形态 | 酸及其浓度 |
| 1.实验Ⅰ和Ⅱ探究盐酸浓度对该反应速率的影响 2.实验Ⅱ和Ⅲ探究:③ 3.实验Ⅱ和Ⅳ探究金属规格(铝片、铝粉)对该反应速率的影响 4.Ⅰ、Ⅱ、Ⅲ实验探究铝与稀盐酸和稀硫酸反应的差异 | Ⅰ | 25℃ | 铝片 | 4.0moL/L盐酸 |
| Ⅱ | 25℃ | 铝片 | 2.0mol•L-1盐酸 | |
| Ⅲ | 35℃ | 铝片 | 2.0mol•L-1盐酸 | |
| Ⅳ | 25℃ | 铝片 | 2.0moL/L盐酸 | |
| Ⅴ | 25℃ | 铝片 | 2.0mol•L-1硫酸 |
分析 (1)实验Ⅰ和Ⅱ探究盐酸浓度对该反应速率的影响,则除了浓度不同以外,其它条件必须完全相同,据此判断Ⅰ的温度及盐酸浓度;根据实验Ⅱ和Ⅲ的数据可知,除温度不同外,其它条件完全相同,则探究的是温度对反应速率的影响;实验Ⅱ和Ⅳ探究金属规格(铝片,铝粉)对该反应速率的影响,则除了铝的规格不同以外,其它条件必须完全相同;
(2)对比Ⅰ、Ⅱ和Ⅴ实验可知,除了氯离子和硫酸根离子不同以外,其它条件完全相同,据此判断影响反应速率因素为氯离子和硫酸根离子.
解答 解:(1)根据实验目的可知:实验Ⅰ和Ⅱ探究盐酸浓度对该反应速率的影响,则除盐酸浓度的浓度不同外,其它条件必须完全相同,所以Ⅰ的温度为25℃,酸及浓度为:4.0moL/L盐酸;
根据实验Ⅱ和Ⅲ的数据可知,除温度不同外,其它条件完全相同,则实验Ⅱ和Ⅲ探究的是反应温度对反应速率的影响;
实验Ⅱ和Ⅳ探究金属规格(铝片,铝粉)对该反应速率的影响,则除铝的规格不同以外,其它条件必须完全相同,所以Ⅳ中温度 25℃、酸及浓度为:2.0moL/L盐酸,
故答案为:
| 实验目的 | 实验编号 | 温度 | 金属铝的形态 | 酸及浓度 |
2.探究温度对反应速率的影响 | Ⅰ | 25℃ | 4.0moL/L盐酸 | |
| Ⅱ | ||||
| Ⅲ | ||||
| Ⅳ | 25℃ | 2.0moL/L盐酸 | ||
| Ⅴ |
点评 本题考查了影响化学反应速率的因素,题目难度中等,熟练掌握温度、浓度、固体物质的表面积等因素对反应速率的影响为解答关键,注意设计对照试验的方法与要求,试题培养了学生的分析能力及化学实验能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
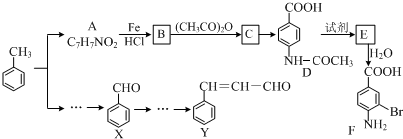
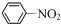 $→_{HCl}^{Fe}$
$→_{HCl}^{Fe}$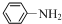
 +(CH3CO)2O→
+(CH3CO)2O→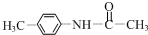 +CH3COOH.在合成F的过程中,B→C步骤不能省略,理由是氨基易被氧化,在氧化反应之前需先保护氨基.
+CH3COOH.在合成F的过程中,B→C步骤不能省略,理由是氨基易被氧化,在氧化反应之前需先保护氨基.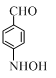 、
、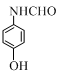 、
、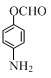 (写出3个).
(写出3个).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
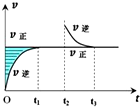
| A. | 该反应的Z和W-定不为气态 | |
| B. | t1-t2与t3-t4两时段,反应体系的气体平均摩尔质量不可能相等 | |
| C. | 该温度下,若此反应的平衡常数表达式为K=[X],则t1-t2与t3-t4两时段的c(X)相同 | |
| D. | 若在高温条件下,该反应才能自发进行,则该反应的平衡常数K随温度升高而增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化铝陶瓷、氮化硅陶瓷都属于新型无机非金属材料 | |
| B. | 煤矿井下的瓦斯爆炸主要是氢气燃烧引起的 | |
| C. | 乙烯的产量是衡量一个国家石油化工发展水平的标志 | |
| D. | 在粉尘较多的工作场所,工作人员易患硅肺病 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若甲为铜,丁为氯化亚铁,则该反应为置换反应 | |
| B. | 若甲为碳,丁为硅,则丙一定是二氧化碳 | |
| C. | 若甲为铝,丁为三氧化二铝,则丙可能是镁 | |
| D. | 若甲为NH4+,乙为OH-,则甲、乙、丙、丁4种粒子均含10个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向AgCl的悬浊液中加入KI溶液,沉淀由白色转化为黄色 | |
| B. | 向AgCl的饱和溶液中加入KCl晶体,有AgCl析出且溶液中c(Ag+)=c(Cl-) | |
| C. | 常温下,AgCl在饱和KCl溶液中的Ksp比在纯水中的Ksp小 | |
| D. | 将0.001 mol•L-1的AgNO3溶液滴入NaCl和NaI的混合溶液中,一定先产生AgI沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 向氨水中滴入稀硫酸:H++OH-═H2O | |
| B. | 向硫酸铝溶液中滴入过量的氨水:Al3++4OH-═AlO2-+2H2O | |
| C. | 向饱和氨水中通过量的CO2气体:NH3+H2O+CO2═NH4++HCO3- | |
| D. | 向氯化铵的稀溶液中滴入少量的NaOH溶液:NH4++OH-═NH3•H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com