
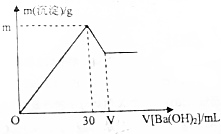
 现有10mL1mol/LAl2(SO4)3溶液,向其中逐滴滴加一定物质的量浓度的Ba(OH)2溶液,产生沉淀的质量与加入Ba(OH)2溶液体积的关系如图所示.(已知:Al3++3OH-=Al(OH)3↓,Al(OH)3+OH-=AlO2-+2H2O)
现有10mL1mol/LAl2(SO4)3溶液,向其中逐滴滴加一定物质的量浓度的Ba(OH)2溶液,产生沉淀的质量与加入Ba(OH)2溶液体积的关系如图所示.(已知:Al3++3OH-=Al(OH)3↓,Al(OH)3+OH-=AlO2-+2H2O)分析 (1)由于是向10mL1mol/LAl2(SO4)3溶液,向其中逐滴滴加一定物质的量浓度的Ba(OH)2溶液,故开始Al3+转变为Al(OH)3沉淀,故化学方程式为:
Al2(SO4)3+3Ba(OH)2=2Al(OH)3↓+3BaSO4↓.根据反应可知,Al3+和SO42-能同时沉淀完全,从而得沉淀的最大量,故加入氢氧化钡溶液30mL时,Al2(SO4)3和Ba(OH)2的物质的量之比为1:3,据此求出所需的氢氧化钡的物质的量和物质的量浓度;
(2)m的值即Al2(SO4)3溶液和Ba(OH)2溶液恰好完全反应生成Al(OH)3和BaSO4沉淀的质量;
30mL-VmL氢氧化钡溶液的作用是将生成的氢氧化铝沉淀溶解,故根据氢氧化铝的物质的量即可求出氢氧化钡的物质的量,从而求出V的值.
解答 解:(1)由于是向10mL1mol/LAl2(SO4)3溶液,向其中逐滴滴加一定物质的量浓度的Ba(OH)2溶液,故开始Al3+转变为Al(OH)3沉淀,故化学方程式为:
Al2(SO4)3+3Ba(OH)2=2Al(OH)3↓+3BaSO4↓.根据反应可知,Al3+和SO42-能同时沉淀完全,从而得沉淀的最大量.Al2(SO4)3的物质的量n=CV=1mol/L×0.01L=0.01mol,设当得到沉淀的最大量时,氢氧化钡的物质的量为xmol,
则有:Al2(SO4)3+3Ba(OH)2=2Al(OH)3↓+3BaSO4↓
1 3
0.01mol xmol
故有:$\frac{1}{0.01mol}=\frac{3}{xmol}$
解得x=0.03mol
由于氢氧化钡体积为30mL,故氢氧化钡的物质的量浓度c=$\frac{0.03mol}{0.03L}$=1mol/L.
答:氢氧化钡溶液的浓度为1mol/L.
(2)m的值即Al2(SO4)3溶液和Ba(OH)2溶液恰好完全反应生成Al(OH)3和BaSO4沉淀的质量,设Al2(SO4)3溶液和Ba(OH)2溶液恰好完全反应生成Al(OH)3和BaSO4沉淀时,生成的Al(OH)3和BaSO4沉淀的物质的量分别为ymol和Zmol,则有:
Al2(SO4)3+3Ba(OH)2=2Al(OH)3↓+3BaSO4↓
1 2 3
0.01mol ymol zmol
故有:$\frac{1}{0.01mol}=\frac{2}{ymol}=\frac{3}{zmol}$
解得y=0.02mol
z=0.03mol
故沉淀的质量m=0.02mol×78g/mol+0.03mol×233g/mol=8.55g;
30mL至VmL氢氧化钡溶液的作用是将生成的氢氧化铝沉淀溶解,由于氢氧化铝的物质的量为0.02mol,设消耗的氢氧化钡的物质的量为Qmol,根据反应可知:
Al(OH)3+OH-=AlO2-+2H2O
1 1
0.02mol 2Qmol
故有:$\frac{1}{0.02mol}=\frac{1}{2Qmol}$
解得Q=0.01mol
故所需的氢氧化钡的体积VmL-30mL=$\frac{n}{C}$=$\frac{0.01mol}{1mol/L}$=0.01L=10mL
故V=40mL.
答:m的值为8.55g,V的值为40mL.
点评 本题考查了根据图象和化学方程式进行的有关计算,难度中等,应注意的是由于是将氢氧化钡向硫酸铝溶液中滴加,故铝离子先转化为氢氧化铝沉淀,后溶解.


科目:高中化学 来源: 题型:推断题
 ,B 同周期第一电离能最小的主族元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B 同周期第一电离能最小的主族元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题: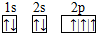 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 甲肾上腺素的分子式为:C8H10NO3 | |
| B. | 1 mol去甲肾上腺素最多能与2 mol Na发生反应 | |
| C. | 1 mol去甲肾上腺素最多能与2 mol Br2发生取代反应 | |
| D. | 去甲肾上腺素能发生加成、取代、消去和氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 名称为:2,5-二甲基-2,4-己二烯
名称为:2,5-二甲基-2,4-己二烯 名称为:2,4-二甲基-3-乙基戊烷.
名称为:2,4-二甲基-3-乙基戊烷.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
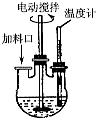 实验室制取高纯NaI晶体(无色)可按下列步骤进行:按化学计量称取各原料,在三颈烧瓶中(如图)先加入适量的高纯水,然后按Na2CO3、I2和水合肼的投料顺序分批加入.
实验室制取高纯NaI晶体(无色)可按下列步骤进行:按化学计量称取各原料,在三颈烧瓶中(如图)先加入适量的高纯水,然后按Na2CO3、I2和水合肼的投料顺序分批加入.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com