
分析 (1)属于氧化还原反应,说明该反应中有电子转移,其特征是有元素化合价升降,据此分析解答;
(2)在氧化还原反应中,化合价升高值=化合价降低值=转移电子数,化合价升高元素所在反应物是还原剂,化合价降低元素所在反应物是氧化剂,根据原子守恒计算被氧化的HCl的物质的量.
解答 解:(1)A.(NH4)2SO3$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+H2O+SO2↑ 各元素化合价不变,所以不属于氧化还原反应,故错误;
B.2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2中C、O元素化合价变化,则有电子转移,属于氧化还原反应,故正确;
C.2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑中C、Si元素化合价变化,则有电子转移,属于氧化还原反应,故正确;
D.NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$N2O+2H2O中N元素化合价变化,则有电子转移,属于氧化还原反应,故正确;
E.CaCO3+CO2+H2O=Ca(HCO3)2各元素化合价不变,所以不属于氧化还原反应,故错误;
F.MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O中Mn、Cl元素化合价变化,则有电子转移,属于氧化还原反应,故正确;
故选:BCDF;
(2)在MnO2+4HCl (浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O的反应中,锰元素化合价降低,氧化剂为MnO2,氯元素化合价升高,还原剂是HCl,氧化产物是Cl2,转移电子数为2mol,用“双线桥法”表示氧化还原反应中电子转移情况为: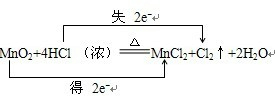 ,根据氯原子守恒,若产生了标准状况下3.36升的氯气,则被氧化的HCl的物质的量为$\frac{3.36}{22.4}$×2=0.3mol,
,根据氯原子守恒,若产生了标准状况下3.36升的氯气,则被氧化的HCl的物质的量为$\frac{3.36}{22.4}$×2=0.3mol,
故答案为:①MnO2;Cl2;② ;③0.3.
;③0.3.
点评 本题考查学生氧化还原反应的判断及其分析,根据元素化合价变化来分析解答,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
 氟是非金属性最强的元素.
氟是非金属性最强的元素. ,其中氧原子采用的轨道杂化方式是sp3,又如O2F2是一种强氧化剂,运用VSEPR模型判断O2F2极性(填“极性”或“非极性”)分子.
,其中氧原子采用的轨道杂化方式是sp3,又如O2F2是一种强氧化剂,运用VSEPR模型判断O2F2极性(填“极性”或“非极性”)分子.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 《X射线金相学》中记载关于铜与金可形成两种有序的金属互化物,其结构如图.下列有关说法不正确的是( )
《X射线金相学》中记载关于铜与金可形成两种有序的金属互化物,其结构如图.下列有关说法不正确的是( )| A. | 图Ⅰ、Ⅱ中物质的化学式不相同 | |
| B. | 图Ⅱ中物质的化学式为CuAu3 | |
| C. | 图Ⅱ中与每个铜原子紧邻的铜原子有6个 | |
| D. | 设图Ⅰ中晶胞的边长为a cm,则图Ⅰ中合金的密度为$\frac{261}{NA{a}_{3}}$ g•cm-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 将CO2转化为 CH4,既可以减少温室气体的排放,又能得到清洁能源.已知:
将CO2转化为 CH4,既可以减少温室气体的排放,又能得到清洁能源.已知:| A. | 0~25h内,催化剂Ⅰ的催化效果比催化剂Ⅱ的效果好 | |
| B. | 0~16h内,v(H2O)Ⅰ=1.5 mol/(L•h) | |
| C. | 在两种不同催化剂下,该反应的平衡常数不相等 | |
| D. | 反应开始后的15h内,第Ⅰ种催化剂的作用下,得到的CH4最多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Ca2+、HCO3-、SO42- | B. | Cl-、NO3-、Fe2+、H+ | ||
| C. | Na+、OH-、NO3-、Ba2+ | D. | K+、Mg2+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某同学在实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和如图所示装置进行测定中和热的实验,得到表中的数据:
某同学在实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和如图所示装置进行测定中和热的实验,得到表中的数据:| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com