
| ||


 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:
 实验制取乙烯时,应将乙醇和浓硫酸快速加热到170℃,在140℃时会生成乙醚,温度过高会使部分乙醇跟浓H2SO4反应生成SO2、CO2、水蒸气.
实验制取乙烯时,应将乙醇和浓硫酸快速加热到170℃,在140℃时会生成乙醚,温度过高会使部分乙醇跟浓H2SO4反应生成SO2、CO2、水蒸气.| 浓硫酸 |
| 170℃ |
| 浓硫酸 |
| 170℃ |
| 浓硫酸 |
| 140℃ |
| 浓硫酸 |
| 140℃ |
| 高温 |
| 高温 |
查看答案和解析>>
科目:高中化学 来源: 题型:
实验制取乙烯时,应将乙醇和浓硫酸快速加热到170℃,在140℃时会生成乙醚,温度过高会使部分乙醇跟浓H2SO4反应生成SO2、CO2、水蒸气。
(1)分别写出乙醇跟浓H2SO4反应生成①脱水生成CH2=CH2;②分子间脱水生成CH3CH2-O-CH2CH3;③SO2、CO2、水蒸气的化学方程式
① ;
② ;
③ ;
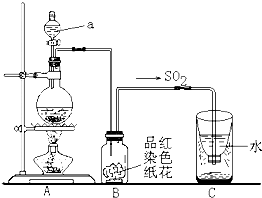
(2)二氧化硫是大气污染物之一,空
气中的二氧化硫随雨水下降形成酸雨。如下图实验装置,对酸雨的形成进行模拟并验证二氧化硫的部分性质,请回答:
①指出图中仪器a的名称: 。
②B装置中淡红色纸花的颜色逐渐变褪去,说明SO2有 性。
③反应结束后取出C装置中少量液体,滴加紫色石蕊试液后变 色。
④实验完毕后。为了使多余的二氧化硫被充分吸收,C装置应如何改进?
(用文字说明) 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江西省吉安市二中高三上学期周测化学试卷(带解析) 题型:实验题
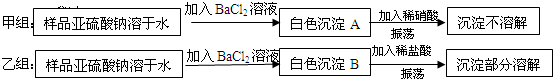
(15分)二氧化硫是大气污染物之一,为粗略测定周围环境中二氧化硫的含量,某课外活动小组的甲、乙两位同学分别用相同实验装置和溶液,测定同一时间, 同一地点空气(含SO2、N2、O2气体,其他气体忽略)中SO2的含量。实验装置如右图反应试管中装有碘的淀粉稀溶液A。 SO2和I2发生反应为:S02+I2+2H20=H2SO4+2HI(N2、02不与I2、 淀粉反应),试回答下列问题:
(1)检查该装置气密性时,先在试管中装入适量的水(保证玻璃管的下端浸在水中),然后_____________________(注意阀的单向性),则证明该装置的气密性良好。
(2)若A溶液的体积为VmL,浓度为c mol·L-1,当溶液的颜色刚好变色,停止抽气,此时甲、乙两位同学注射器内抽得气体的体积分别为V甲mL、V乙mL(所有的体积已折算成标况下体积),且V甲>V乙,则甲、乙两个测定结果中与该地点空气中S02的体积分数真实情况最接近的是_______________________(.用含c、V、V甲或V乙…等的关系式表示)。另一位实验结果产生较大误差的原因可能是_______________________________________________
(3)若将上述装置进行改进,除导管外,重新连接装置需要选用的仪器有___________________。 (选下列仪器的编号)
a、烧杯 b、试管 c、锥形瓶 d、容量瓶e、量筒 f、单孔塞 g.双孔塞
(4)欲净化空气,除去空气中的二氧化硫可选用的试剂是___________________。
查看答案和解析>>
科目:高中化学 来源:2012届江苏省海门市高二下学期期末教学质量调研化学试题 题型:填空题
氮是地球上极为丰富的元素。
(1)N2是大气的主要成分之一,由于分子中键能很大,所以性质稳定。已知N≡N的键能为946 kJ·mol-1,N—N单键的键能为193 kJ·mol-1。
计算:N2分子中“π”键的键能约为 ;
结论:N2分子中“σ”和“π”键的稳定性 。
(2)氮的氧化物是大气污染物之一。为了消除污染,科研人员设计了同时消除二氧化硫和氮的氧化物的方法,其工艺流程如下:
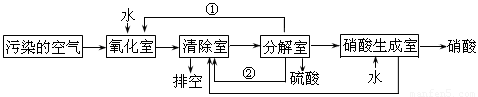
其中清除室、分解室发生的反应如下:
清除室:NO + NO2 = N2O3 N2O3 + 2H2SO4 = 2NOHSO4 + H2O
分解室:4NOHSO4 + O2 + 2H2O = 4H2SO4 + 4NO2
回答下列问题:
Ⅰ.①和②分别为(写化学式) 、 ;
Ⅱ.氧化室发生的反应是 ;
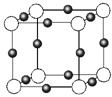
(3)金属氮化物是一类重要的化学物质,有着特殊的用途。某金属离子(M+)与N3—形成的晶体结构如右图所示。其中M+中所有电子正好充满K、L、M三个电子层,它M+的符号是 ,与同一个N3-相连的M+有 个。
(4)NH3既是重要的工业产品,又是主要的工业原料。以NH3为原料生产硝酸铵的过
程如下:
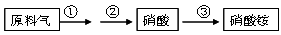
其中反应②为:4NO+3O2+2H2O=4HNO3 原料气为氨气和空气的混合物,假设空气中氧气的体积分数为0.2。
Ⅰ.写出反应①的化学方程式 。若不考虑副反应且各步反应均完全,生产过程中原料气中的氨气(不包含第③步被硝酸吸收的氨气)和空气中氧气恰好全部转化为硝酸,则原料气中制备硝酸的氨气和氧气的体积比为 。
Ⅱ.若实际生产中,反应①中氨的转化率(或利用率)为70%,反应②中NO的转化率为90%,反应③中氨和硝酸均完全转化。则生产硝酸的氨气占所用氨气总量的体积分数为多少?(写出计算过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com