
【题目】工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g) +2H2(g) ![]() CH3OH(g) ΔH
CH3OH(g) ΔH
(1)判断反应达到平衡状态的依据是______(填序号)。
a.生成CH3OH的速率与消耗CO的速率相等 b.混合气体的密度不变
c.混合气体的总物质的量不变 d.CH3OH、CO、H2的浓度都不再发生变化
(2)CO在不同温度下的平衡转化率与压强的关系如图1。
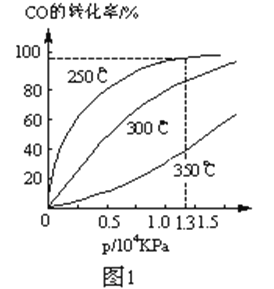
实际生产条件控制在250℃、1.3ⅹ104 kPa左右,选择此压强的理由是______。
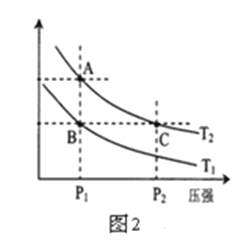
(3)右图2表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A______C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A______C,由状态B到状态A,可采用______的方法(填“升温”或“降温”)。
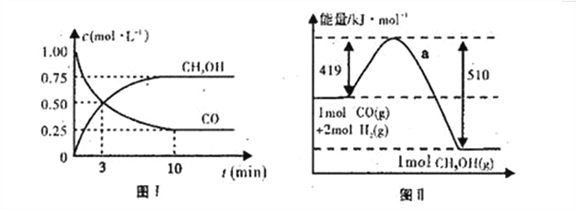
(4)图I是反应时CO和CH3OH的浓度随时间的变化情况,从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)=______。
(5)写出该反应的热化学方程式______________________________
(6)当温度升高时,该平衡常数K将________(填“增大”、“减小”或“不变”)。
(7)恒容条件下,下列措施中能使![]() 增大的有______
增大的有______
A.升高温度 B.充入He气 C.再充入1molCO和2molH2 D.使用催化剂
(8)在恒温条件下,保持CO浓度不变,扩大容器体积,则平衡______(填“逆向移动”、“正向移动”、“不移动”)
【答案】 c d 在1.3×104kPa下,CO的转化率已经较高,再增大压强CO的转化率提高不大,而成本增加,得不偿失 < = 升温 v(CO)= 0.075mol·L-1·min-1 CO(g) +2H2(g) ![]() CH3OH(g) ΔH= -91 kJ·mol-1 减小 C 逆向移动
CH3OH(g) ΔH= -91 kJ·mol-1 减小 C 逆向移动
【解析】(1)a、生成CH3OH的速率与消耗CO的速率都是正反应速率,无法判断是否达到平衡状态,a错误;b、容器容积固定,气体的质量不变,故气体的密度始终不变,不能据此说明反应达到平衡状态,b错误;c、反应前后都是气体,化学计量数之和不相等,故混合气体的总物质的量不变,可以判断达到了平衡状态,c正确;d、反应物和生成物的浓度不变,生成速率等于消耗速率,正逆反应速率相等,达到了平衡状态,d正确;答案选cd;(2)由于在1.3×104kPa下,CO的转化率已经较高,再增大压强CO的转化率提高不大,而成本增加,得不偿失,因此实际生产条件控制在250℃、1.3ⅹ104 kPa左右;(3)根据图2可知A、C两点温度相同,C点的压强大于A点,故反应速率:A<C;由于温度相同,故A、C的化学平衡常数相等;根据图1压强相等情况下,升高温度,CO转化率降低,说明反应为放热,B点氢气的含量小于A点的,因此若要提高氢气的含量,必须升高温度;(4)根据图I可判断从反应开始到平衡CO浓度减少了0.75mol/L,则用CO浓度变化表示的平均反应速率v(CO)=0.75mol/L÷10min=0.075mol·L-1·min-1。(5)根据图Ⅱ可知反应热是419kJ/mol-510kJ/mol=-91kJ/mol,因此该反应的热化学方程式为CO(g)+2H2(g)![]() CH3OH(g) ΔH=-91 kJ·mol-1;(6)A.升高温度平衡逆向移动,
CH3OH(g) ΔH=-91 kJ·mol-1;(6)A.升高温度平衡逆向移动,![]() 减小,A错误;B.充入He气,平衡不移动,
减小,A错误;B.充入He气,平衡不移动,![]() 不变,B错误;C.再充入1molCO和2molH2相当于增大压强,平衡正向移动,
不变,B错误;C.再充入1molCO和2molH2相当于增大压强,平衡正向移动,![]() 增大,C正确;D.使用催化剂,平衡不移动,
增大,C正确;D.使用催化剂,平衡不移动,![]() 不变,D错误;答案选C;(8)该反应是气体体积减小的反应,扩大容器体积,压强减小,平衡向体积增大的方向移动,也就是平衡逆向移动。
不变,D错误;答案选C;(8)该反应是气体体积减小的反应,扩大容器体积,压强减小,平衡向体积增大的方向移动,也就是平衡逆向移动。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列事实或性质与胶体没有直接关系的是( )
A.在河流入海处易形成三角洲
B.用微波手术刀进行外科手术,可使开到处的血液迅速凝固,减少失血
C.同一钢笔使用不同牌号的墨水容易堵塞
D.氢氧化铁固体溶于盐酸得澄清溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硅单质及其化合物的说法正确的是
①硅是构成一些岩石和矿物的基本元素
②水泥、玻璃、陶瓷都是硅酸盐产品
③高纯度的硅单质广泛用于制作光导纤维
④普通玻璃是氧化物,成分可表示为SiO2
⑤粗硅制备单晶硅不涉及氧化还原反应
A. ①② B. ①②③ C. ①②③④ D. ②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应方程式如下:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
(1)写出该反应的离子方程式______________________________。
(2)该反应的氧化剂为_____________,氧化产物是___________。
(3)用双线桥法表明该反应电子转移的方向和数目。______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下氢氧化锌在碱性溶液中的变化如图所示,横坐标为溶液的pH,纵坐标为Zn2+或Zn022-的物质的量浓度的对数,下列说法正确的是
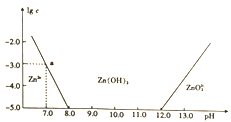
A. 依图中数据计算可得该温度下Zn(OH)2的溶度积(Ksp)=1×10-17
B. 溶液中加入足量氨水,发生反应的离子方程式为Zn2++40H-=ZnO22-+2H2O
C. 为提取工业废液中的Zn2+,可以控制溶液的pH在13左右
D. Zn2+在溶液中的存在形式与Al3+相似,碱性溶液中只以Zn(OH)2形式存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃结构式如下:![]() ,有关其结构说法正确的是
,有关其结构说法正确的是
A. 所有原子可能在同一平面上 B. 该分子不存在顺反异构
C. 所有碳原子可能在同一平面上 D. 1 mol 该烃最多可与4 mol氢气反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)2017年5月,我国在南海成功开采“可燃冰”(甲烷水合物),标志着在技术方面取得了突破性进展。甲烷是优质的清洁能源,综合开发利用能有效缓解大气污染问题。
已知:CH4(g)+2O2(g)=CO2(g) +2H2O(g) ΔH =- 802 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) ΔH =-566kJ·mol-1
H2O(g)=H2O(l) ΔH =- 44kJ·mol-1
则1mol CH4(g)不完全燃烧生成CO和H2O(l) 的热化学方程式为:________________。
(2)甲烷转化为CO和H2的反应为:CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH>0。
CO(g)+3H2(g) ΔH>0。
①一定条件下,CH4的平衡转化率与温度、压强的关系如下图1所示。则P1________P2(填“<”、“>”或“=”) ;A、B、C 三点处对应的平衡常数(KA、KB、KC)由大到小的顺序为___________________。
②将CH4和H2O(g)按等物质的量混合,一定条件下反应达到平衡,CH4转化率为50%。则反应前与平衡后,混合气体的平均相对分子质量之比为________________。
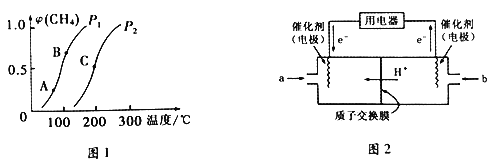
(3)甲烷燃料电池工作原理如上图2所示。a气体是______________,b气体通入电极的反应式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.2.L-1H2A溶液中滴另加0.2mol.L-1NaOH溶液。有关微粒的物质的量变化如图所示。根据图示判断正确的是
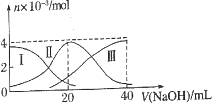
A. Ⅰ线表示A2-,Ⅱ线表示HA-
B. NaHA溶液中c(H+)>c(OH-)
C. 当V(NaOH)=21mL时:c(Na+)>c(A2-)>c(HA-)
D. 当V(NaOH)=40mL时:c(Na+)=2c(A2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是 ( )
A. 硝酸铝溶液中加入过量氨水:Al3++4NH3·H2O==AlO2-+4NH4++2H2O
B. 向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2+H2O==HClO+HSO3-
C. 钠投入CuSO4溶液中:2Na+Cu2++2H2O==2Na++Cu(OH)2↓+H2↑
D. 铁和过量稀HNO3反应后,溶液pH=2: 3Fe+8H++2NO3-==3Fe2++2NO↑+4H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com