
【题目】在某100mL混合液中,HNO3和H2SO4的物质的量浓度分别是0.4mol/L和0.1mol/L。向该混合液中加入1.92g铜粉,加热,待充分反应后,所得溶液中的Cu2+的物质的量浓度是( )mol/L
A. 0.15 B. 0.225 C. 0.35 D. 0.45
【答案】B
【解析】
铜屑投入HNO3和H2SO4的混合溶液中发生的反应实质为硫酸提供氢离子硝酸根离子具有强氧化性继续反应,反应实质为:3Cu+8H++2NO3-=3Cu2++2NO↑+3H2O,根据反应的量来确定消耗的铜以及生成气体的量,生成铜离子的物质的量分析判断。
反应实质为:3Cu+8H++2NO3-=3Cu2++2NO↑+3H2O,1.92g铜粉物质的量=![]() =0.03mol,100mL混合溶液中,HNO3和H2SO4的物质的量浓度分别是0.4mol/L和0.1mol/L,所含氢离子物质的量=0.1L×0.4mol/L+0.1L×0.1mol/L×2=0.06mol,根据反应离子方程式可以知道铜剩余,根据氢离子物质的量计算生成铜离子物质的量为8H+~3Cu2+,得到铜离子物质的量为0.06mol ×
=0.03mol,100mL混合溶液中,HNO3和H2SO4的物质的量浓度分别是0.4mol/L和0.1mol/L,所含氢离子物质的量=0.1L×0.4mol/L+0.1L×0.1mol/L×2=0.06mol,根据反应离子方程式可以知道铜剩余,根据氢离子物质的量计算生成铜离子物质的量为8H+~3Cu2+,得到铜离子物质的量为0.06mol ×![]() =0.0225mol,所得溶液中Cu2+物质的量浓度为
=0.0225mol,所得溶液中Cu2+物质的量浓度为![]() =0.225mol/L,
=0.225mol/L,
所以B选项是正确的。


科目:高中化学 来源: 题型:
【题目】在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。

回答下列问题:
(1)反应的△H_______0(填“大于”或“小于”) ;100℃时,体系中各物质浓度随时间变化如上图所示。在0-60s时段,反应速率v(N2O4)为______mol·L-1·s-1;反应的平衡常数K1为________。
(2) 100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020mol·L-1·s-1的平均速率降低,经10s又达到平衡。
a: T______100℃ (填“大于”或“小于”) ,判断理是_______
b:计算温度T时反应的平衡常数K2(要求写出计算过程)__________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向______(填“正反应”或“逆反应”)方向移动,判断理由是__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A.氢氧化铝可用于中和过多胃酸
B.赏心悦目的雕花玻璃可用HF刻蚀而成
C.空气质量报告中有可吸入颗粒、SO2、NO2、CO2
D.光化学烟雾的形成与氮氧化物有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将![]() 体积NO和
体积NO和![]() 体积O2同时通入倒立于水中且盛满水的容器中,充分反应后,容器内残留
体积O2同时通入倒立于水中且盛满水的容器中,充分反应后,容器内残留![]() 体积的气体,该气体与空气接触变为红棕色,则
体积的气体,该气体与空气接触变为红棕色,则![]() 为( )
为( )
A. 3:2 B. 2:3 C. 8:3 D. 3:8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼化钒(VB2)-空气电池是目前储电能力最高的电池,电池示意图如下,该电池工作时反应为:4VB2+11O2=4B2O3 +2V2O5。下列说法不正确的是
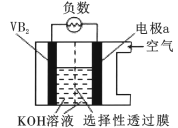
A. 电极a 为电池正极
B. 图中选择性透过膜为阴离子透过性膜
C. 电池工作过程中,电极a附近区域pH减小
D. VB2极发生的电极反应为:2VB2 +22OH--22e- = V2O5+2B2O3 + 11H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,能长时间保持稳定的放电电压。其电池总反应为:3Zn + 2K2FeO4 + 8H2O![]() 3Zn(OH)2 + 2Fe(OH)3 + 4KOH,下列叙述不正确的是
3Zn(OH)2 + 2Fe(OH)3 + 4KOH,下列叙述不正确的是
A. 放电时负极反应为:Zn-2e-+2OH-= Zn(OH)2
B. 充电时阳极发生氧化反应,附近溶液碱性增强
C. 充电时每转移3mol电子,阴极有1.5molZn生成
D. 放电时正极反应为:FeO42- + 3e- + 4H2O = Fe(OH)3 + 5OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以甲烷为原料合成甲醇的反应如下:
反应I:CH4(g) + CO2(g) ![]() 2CO(g) + 2H2(g) △H1= +247 kJ/mol
2CO(g) + 2H2(g) △H1= +247 kJ/mol
反应II:CO(g) + 2H2(g)![]() CH3OH(g) △H2=-90kJ/mol
CH3OH(g) △H2=-90kJ/mol
已知: T1℃时,反应II 的平衡常数数值为100;T2℃时,反应II 在密闭容器中达到平衡,测得CO、H2、CH3OH的物质的量浓度(mol/L)分别为0.05、0.1、0.1。下列说法中,正确的是
A. 反应I中,使用催化剂可以减小△H1,提高反应速率
B. 反应II 中,加热或加压均可提高原料气的平衡转化率
C. 由上述数据可判断反应II 的温度: T1> T2
D. CO(g)+CH3OH(g)![]() CH4(g) +CO2(g) △H= +157 kJ/mol
CH4(g) +CO2(g) △H= +157 kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com