
已知X、Y元素同周期,且电负性X>Y,下列说法错误的是( )
A. X与Y形成化合物时X显负价,Y显正价
B. 第一电离能X大于Y
C. 最高价氧化物对应的水化物的酸性:X强于Y
D. 气态氢化物的稳定性:HmX强于HmY
考点: 原子结构与元素的性质.
分析: X、Y元素同周期,且电负性X>Y,则非金属性X>Y.
A.电负性大的元素在化合物中显负价;
B.一般非金属性强的,其第一电离能大,但是第IIA和IIIA,第VA和VIA反常;
C.非金属性越强,最高价氧化物对应的水化物的酸性越强;
D.非金属性越强,气态氢化物越稳定.
解答: 解:X、Y元素同周期,且电负性X>Y,则非金属性X>Y.
A.电负性大的元素在化合物中显负价,所以X和Y形成化合物时,X显负价,Y显正价,故A正确;
B.一般非金属性强的第一电离能大,但特殊O的非金属性比N大,但第一电离能N>O,所以第一电离能可能Y小于X,故B错误;
C.非金属性越强,最高价氧化物对应的水化物的酸性,则最高价氧化物对应的水化物的酸性:X强于Y,故C正确;
D.非金属性越强,气态氢化物越稳定,则气态氢化物的稳定性:HmY小于HnX,故D正确;
故选B.
点评: 本题考查位置、结构、性质,明确同周期位置关系及电负性大小得出元素的非金属性是解答本题的关键,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
下列叙述中正确的是()
A. 在稀溶液中,1mol酸和1mol碱完全反应所放出的热量,叫做中和热
B. 热化学方程式中,各物质前的化学计量数不表示分子个数
C. 在101kPa时,1mol物质燃烧时所放出的热量叫做该物质的燃烧热
D. 如果反应物所具有的总能量小于生成物所具有的总能量,则反应放热
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中一定能大量共存的是()
A. 无色溶液中:K+、H+、Fe2+、NO3﹣
无色溶液中:K+、H+、Fe2+、NO3﹣
B. c(H+)<c(OH﹣)的溶液中:Na+、K+、SO42﹣、ClO﹣
C. 含0.1mol•L﹣1 HCO3﹣的溶液中:Al3+、Ca2+、NO3﹣、SO42﹣
D. 含0.1 mol•L﹣1 SCN﹣的溶液中:Fe3+、NH4+、NO3﹣、Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实与氢键有关的是( )
A. 水加热到很高的温度都难以分解
B. 水结冰成体积膨胀,密度减少
C. CH4、SiH4、GeH4、SnH4熔点随相对分子质量增加而升高
D. HF、HCI、HBr、HI的热稳定性依次减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
断肠草为中国古代九大毒药之一,据记载能“见血封喉”,现代查明它是葫蔓藤科植物葫蔓藤,其中的毒素很多,下列是分离出来的四种毒素的结构式,下列推断不正确的是( )
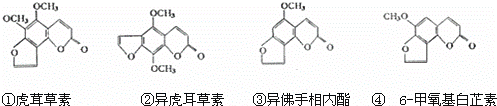
A. ①与②、③与④分别互为同分异构体
B. ①、③互为同系物
C. 等物质的量②、④分别在足量氧气中完全燃烧,前者消耗氧气比后者多
D. ①、②、③、④均能与氢氧化钠溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
图1是元素周期表的一部分,表中所列的字母分别代表一种化学元素.

试回答下列问题:
(1)请写出字母O代表的元素符号 ,该元素在周期表中的位置 .
(2)第三周期8种元素按单质熔点高低的顺序如图2,其中序号“8”代表 (填元素符号);其中电负性最大的是 (填图2中的序号).
(3)由j原子跟c原子以1:1相互交替结合而形成的晶体,晶型与晶体j相同.两者相比熔点更高的是 (填化学式),试从结构角度加以解释: .
(4)k与l形成的化合物kl2的电子式是 ,它在常温下呈液态,形成晶体时,属于
晶体.
(5)i单质晶体中原子的堆积方式如图3(甲)所示,其晶胞特征如图3(乙)所示,原子之间相互位置关系的平面图如图3(丙)所示.
若已知i的原子半径为d,NA代表阿伏加德罗常数,i的相对原子质量为M,请回答:
晶胞中i原子的配位数为 ,一个晶胞中i原子的数目为 ,该晶体的密度为 (用M、NA、d表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
氢气、一氧化碳、辛烷、甲烷燃烧的热化学方程式分别为:
H2(g)+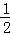 O2(g)=H2O(l)△H=﹣285.8kJ/mol
O2(g)=H2O(l)△H=﹣285.8kJ/mol
CO(g)+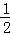 O2(g)=CO2(g)△H=﹣282.6kJ/mol
O2(g)=CO2(g)△H=﹣282.6kJ/mol
C8H18(l)+ O2(g)=8CO2(g)+9H2O(l)△H=﹣5472kJ/mol
O2(g)=8CO2(g)+9H2O(l)△H=﹣5472kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=﹣889.6kJ/mol
相同质量的氢气、一氧化碳、辛烷、甲烷完全燃烧时,放出热量最少的是()
A. H2(g) B. CO(g) C. C8H18(l) D. CH4(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组溶液电解一段时间后,再加入相关物质,溶液能恢复原状况的是()
电解质溶液 阳极 阴极 加入的物质
A NaCl溶液 碳 铁 盐酸
B NaOH溶液 碳 碳 水
C 硫酸铜溶液 铜 碳 硫酸铜
D 硫酸 铁 碳 H2O
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
辉铜矿(主要成分为Cu2S)经火法冶炼,可制得Cu和H2SO4,流程如下图所示:
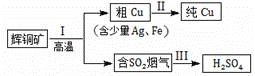
(1) Cu2S中Cu元素的化合价是 价。
(2)Ⅱ中,电解法精炼粗铜(含少量Ag、Fe),CuSO4溶液做电解质溶液:
① 粗铜应与直流电源的 极(填“正”或“负”)相连。
② 铜在阴极析出,而铁以离子形式留在电解质溶液里的原因是 。
(3)Ⅲ中,烟气(主要含SO2、CO2)在较高温度经下图所示方法脱除SO2,并制得H2SO4。
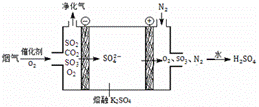
① 在阴极放电的物质是 。
② 在阳极生成SO3的电极反应式是 。
(4)检测烟气中SO2脱除率的步骤如下:
i.将一定量的净化气(不含SO3)通入足量NaOH溶液后,再加入足量溴水。
ii.加入浓盐酸,加热溶液至无色无气泡,再加入足量BaCl2溶液。
iii.过滤、洗涤、干燥,称量沉淀质量。
① 用离子方程式表示i中溴水的主要作用 。
② 若沉淀的质量越大,说明SO2的脱除率越 (填“高”或“低”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com