
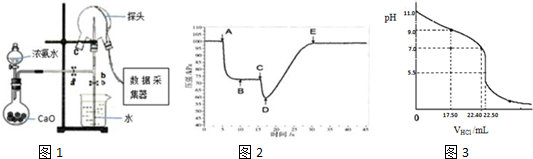
分析 Ⅰ.(1)CaO和水反应生成氢氧化钙且放出热量,放出的热量促进一水合氨分解,据此书写方程式;氨气和水反应生成一水合氨,一水合氨电离出氢氧根离子而导致氨水溶液呈碱性,红色石蕊试液遇碱蓝色,氨气也能和HCl反应生成白烟;
(2)三颈瓶内气体与外界大气压压强之差越大,其喷泉越剧烈;
Ⅱ.(3)可以用移液管或碱式滴定管量取碱性溶液;
(4)氨水的物质的量浓度=$\frac{1}{V{\;}_{m}}$mol/L=$\frac{1}{22.4}$mol/L=0.0450mol/L;pH=11的氨水中c(OH-)=0.001mol/L,c(OH-)≈c(NH4+)=0.001mol/L,c(NH3•H2O)≈0.0450mol/L,根据Kb=$\frac{c(OH{\;}^{-}).c(NH{\;}_{4}{\;}^{+})}{c(N{H}_{3}.H{\;}_{2}O)}$,计算电离平衡常数;
(5)A.锥形瓶中有少量蒸馏水不影响氨水的物质的量;
B.利用pH计判断滴定终点更准确;
C.酸式滴定管未用盐酸润洗会导致盐酸浓度偏低;
D.滴定终点时俯视读数会导致盐酸物质的量偏小.
解答 解:Ⅰ.(1)CaO和水反应生成氢氧化钙且放出热量,放出的热量促进一水合氨分解,该反应方程式为NH3•H2O+CaO=Ca(OH)2+NH3↑;
氨气和水反应生成一水合氨,一水合氨电离出氢氧根离子而导致氨水溶液呈碱性,红色石蕊试液遇碱蓝色,氨气也能和HCl反应生成白烟,所以氨气的检验方法为:将湿润的红色石蕊试纸靠近瓶口c,试纸变蓝色,证明NH3已收满;或:将蘸有浓盐酸的玻璃棒靠近瓶口c,有白烟生成,证明NH3已收满;
故答案为:NH3•H2O+CaO=Ca(OH)2+NH3↑;湿润的红色石蕊试纸;试纸变蓝色;
(2)三颈瓶内气体与外界大气压压强之差越大,其反应速率越快,D点压强最小、大气压不变,所以大气压和D点压强差最大,则喷泉越剧烈,
故答案为:D;
Ⅱ.(3)氨水中含有一水合氨,一水合氨电离出氢氧根离子而使溶液呈碱性,所以用移液管或碱式滴定管量取氨水,
故答案为:碱式滴定管(或移液管);
(4)氨水的物质的量浓度=$\frac{1}{V{\;}_{m}}$mol/L=$\frac{1}{22.4}$mol/L=0.0450mol/L;pH=11的氨水中c(OH-)=0.001mol/L,c(OH-)≈c(NH4+)=0.001mol/L,c(NH3•H2O)≈0.0450mol/L,根据Kb=$\frac{c(OH{\;}^{-}).c(NH{\;}_{4}{\;}^{+})}{c(N{H}_{3}.H{\;}_{2}O)}$=$\frac{0.001×0.001}{0.045}$=2.2×10-5;
故答案为:0.0450;2.2×10-5;
(5)A.锥形瓶中有少量蒸馏水不影响氨水的物质的量,所以不影响测定结果,故A正确;
B.利用pH计判断滴定终点更准确,不需要酸碱指示剂即可,故B错误;
C.酸式滴定管未用盐酸润洗会导致盐酸浓度偏低,则使用盐酸的体积偏大,所以导致测定结果偏高,故C正确;
D.滴定终点时俯视读数会导致盐酸体积偏小,则盐酸物质的量偏小,测定结果偏低,故D错误.
故选AC.
点评 本题考查性质实验方案设计,侧重考查学生分析、判断及实验操作能力,明确滴定原理、喷泉实验原理、弱电解质电离等知识点是解本题关键,(5)题A为易错点,题目难度中等.


 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同物质的量浓度的FeI2溶液与溴水等体积混合 2Fe2++2I-+2Br2═2Fe3++I2+4Br- | |
| B. | Ba(OH)2溶液中加入过量的NaHSO4溶液 Ba2++OH-+H++SO42-═H2O+BaSO4↓ | |
| C. | 氢氧化亚铁溶液于稀硝酸中 Fe(OH)2+2H+═Fe2++2H2O | |
| D. | 向漂白粉溶液中通入少量的二氧化碳 Ca2++2ClO-+CO2+H2O═CaCO3↓+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +1 | B. | +2 | C. | +3 | D. | +4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钾溶液在电流作用下电离成K+和Cl- | |
| B. | 氧化还原反应的本质是有化合价的升降 | |
| C. | 依据丁达尔效应可将分散系分为溶液、胶体与浊液 | |
| D. | 碱性氧化物均属于金属氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe可以和S在加热条件下生成Fe2S3 | |
| B. | Cl2和H2S相遇可发生反应:H2S+Cl2═2HCl+S↓ | |
| C. | 在酸性溶液中,Fe3+和S2-可以大量共存 | |
| D. | Cl2可以氧化Fe3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com